
2022年9月23日,复旦大学代谢与整合生物学研究院陈丰荣青年研究员在SCIENCE CHINA-Life Sciences杂志上在线发表了题为PITPNC1 promotes the thermogenesis of brown adipose tissue under acute cold exposure的论文。PITPNC1是一类可以转运磷脂酰胆碱(PC)、磷脂酰肌醇(PI)和磷脂酸(PA)的磷脂转运蛋白[1-2],该研究团队通过Pitpnc1全身敲除小鼠(Pitpnc1-/-)的动物模型研究该基因的生理调控功能,发现在急性4℃冷刺激下,Pitpnc1-/-小鼠表现出低温不耐受表型,直至低温死亡;进一步生化检测发现,相比于野生型小鼠,Pitpnc1-/-小鼠的血糖含量显着下降、棕色脂肪组织(BAT)中脂肪剩余含量较多,说明了Pitpnc1-/-小鼠正常使用血糖进行产热,并暗指了Pitpnc1基因缺失导致BAT的脂质消耗代谢能力下降,棕色脂肪细胞利用脂肪酸产热功能受损,揭示了Pitpnc1基因在急性冷刺激下对于维持小鼠体温的重要性。

为了探索Pitpnc1-/-小鼠低温不耐受的病理机制,该研究团队进一步检测棕色脂肪细胞内脂质代谢功能的四个关键步骤:脂质摄入、脂质积累、中性脂降解、游离脂肪酸的β氧化等。研究结果显示相对于野生型棕色脂肪细胞,Pitpnc1-/-棕色脂肪细胞在脂质摄入的关键蛋白CD36的表达与膜定位、油酸处理后的脂滴积累、异丙肾上腺素刺激中性脂降解后的脂肪酸与甘油释放等各种代谢指标没有呈现出差异,但Pitpnc1-/-棕色脂肪细胞显现出明显衰弱的氧气消耗速率,并且纯化的线粒体的氧气消耗速率测定也进一步证实这个结果。为了进一步探究Pitpnc1-/-棕色脂肪细胞中线粒体功能缺陷的起因,纯化的线粒体的脂质组学呈现了PITPNC1蛋白缺失会导致线粒体的磷脂酰胆碱(PC)、鞘磷脂(SM)和神经酰胺(Ceramides)含量过度积累,但线粒体上的关键蛋白(如Cpt1、COX4等)并无显着变化。已有文献报导线粒体中的Ceramides过度积累会限制线粒体中脂肪酸的β-氧化[3-5]。这些结果显示PITPNC1蛋白缺失可能通过细胞器间的磷脂转运缺陷引起线粒体的磷脂调控紊乱,最终导致棕色脂肪细胞的线粒体产热功能缺陷(图1)。
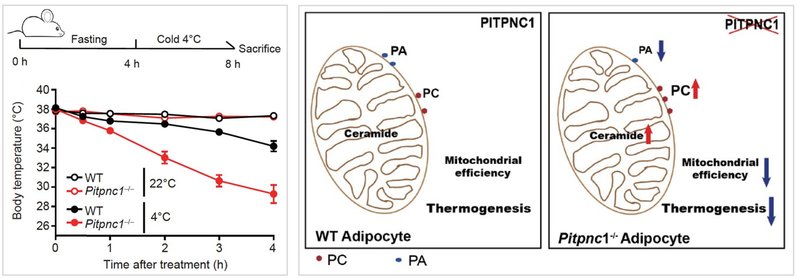
图1. PITPNC1蛋白调控线粒体脂质稳态在急性冷刺激下对于维持小鼠体温的生理功能重要性。
(左)8周饲养的同窝野生型与Pitpnc1-/-雄鼠单笼饥饿4小时后置于22℃或4℃,时间间隔1小时检测小鼠的体温,结果显示PITPNC1是小鼠在急性冷暴露下维持体温所必需的;(右)模型示意图展示PITPNC1调控线粒体脂质稳态对棕色脂肪细胞在急性冷刺激下产热的重要性。
通过上述研究,该研究团队首次揭示了PITPNC1蛋白在急性冷刺激下对于维持小鼠体温的生理功能重要性,其通过调控线粒体的磷脂稳态,进而维持棕色脂肪细胞的线粒体产热功能,此发现对于机体调控产热作用具有重要的理论意义,且Pitpnc1基因有望作为一个靶点用于开发防治肥胖等代谢性疾病的新策略。
复旦大学代谢与整合生物学研究院唐国庆博士、博士生马成新同学为该论文的共同第一作者,复旦大学代谢与整合生物学研究院陈丰荣青年研究员为本研究的通讯作者。同时,上海体育学院王茹教授,复旦大学代谢与整合生物学研究院黄河青年研究员、赵同金教授,郑州大学李蓬教授和澳大利亚新南威尔士大学杨洪远教授对该研究提供了重要的支撑。
论文链接:
https://link.springer.com/article/10.1007/s11427-022-2157-y
参考文献:
Cockcroft, S., and Garner, K. (2011). Function of the phosphatidylinositol transfer protein gene family: is phosphatidylinositol transfer the mechanism of action? Crit Rev BiochemMol Biol 46, 89-117.
Garner, K., Hunt, A.N., Koster, G., Somerharju, P., Groves, E., Li, M., Raghu, P., Holic, R., and Cockcroft, S. (2012). Phosphatidylinositol transfer protein, cytoplasmic 1 (PITPNC1) binds and transfers phosphatidic acid. J Biol Chem 287, 32263-32276.
Chaurasia, B., Ying, L., Talbot, C.L., Maschek, J.A., Cox, J., Schuchman, E.H., Hirabayashi, Y., Holland, W.L., and Summers, S.A. (2021). Ceramides are necessary and sufficient for diet-induced impairment of thermogenic adipocytes. Mol Metab 45, 101145.
Chaurasia, B., Kaddai, V.A., Lancaster, G.I., Henstridge, D.C., Sriram, S., Galam, D.L.A., Gopalan, V., Prakash, K.N.B., Velan, S.S., Bulchand, S., et al. (2016). Adipocyte ceramides regulate subcutaneous adipose browning, inflammation, and metabolism. Cell Metab 24, 820-834.
Zhang, X., Zhang, Y., Wang, P., Zhang, S.Y., Dong, Y., Zeng, G., Yan, Y., Sun, L., Wu, Q., Liu, H., et al. (2019). Adipocyte hypoxia-inducible factor 2α suppresses atherosclerosis by promoting adipose ceramide catabolism. Cell Metab 30, 937-951.e5.




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台