
脂肪酸(FAs)在细胞活动中扮演着不可或缺的角色,涉及β-氧化、能量储存、膜合成、脂质激素和修饰等多种关键活动1-3。几乎所有的组织都能够利用脂肪酸,不同组织在脂肪酸吸收中拥有明确的功能分工,但是它们感应不同的生理状态从而进行脂肪酸吸收的分子机制目前并不清楚。
肌肉组织是人体内体积最大的组织,约占身体总重量的45%。近几十年来的研究中,肌肉疲劳和肌肉损伤是影响运动员有氧竞技能力的主要原因。因此,科学界将肌肉损伤后的愈合过程放在了运动生理学研究的核心位置。肌肉损伤后,肌肉干细胞(也称为卫星细胞)从静止状态切换到增殖状态,激活的肌肉干细胞经历显著的代谢变化,以满足快速增殖的能量需求4-6。然而,对于这些营养物质来源及其如何被肌肉干细胞感知和利用的机制了解甚少。因此,对这个领域的深入研究显得尤为迫切。
2024年1月10日,复旦大学代谢与整合生物学研究院赵同金课题组在Developmental Cell上发表了题为Dynamic palmitoylation of STX11 controls injury-induced fatty acid uptake to promote muscle regeneration的研究论文,发现蛋白质STX11 的动态棕榈酰化调控了肌肉损伤诱导的脂肪酸吸收,从而促进肌肉再生。

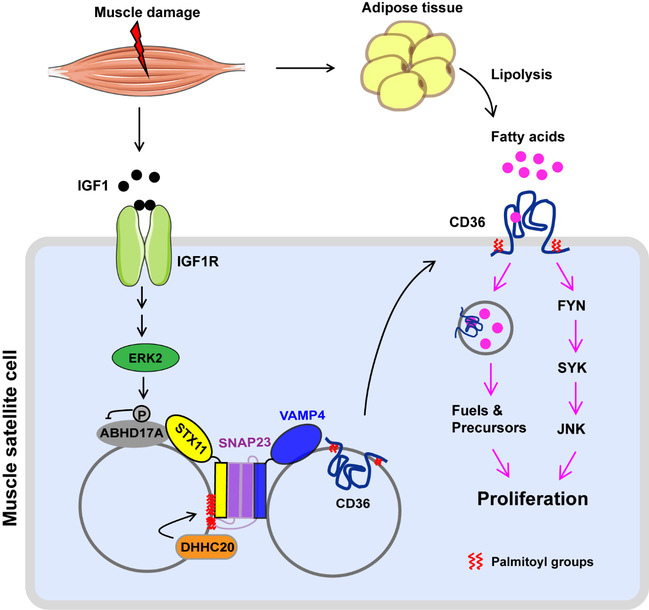
作者首先利用耗竭性锻炼及氯化钡注射的方式构建了人和小鼠的肌肉损伤模型。在人和小鼠中,肌肉损伤后2-3天血液中的游离脂肪酸水平增加。作者的进一步研究证明,在肌肉损伤修复的过程中,从膳食中摄取以及从脂肪酸组织中动员出来的脂肪酸,同时扮演着燃料和信号分子两种角色来促进肌肉再生。
此外,作者鉴定了损伤诱导的肌肉干细胞中脂肪酸吸收的调节机制。作者发现肌肉损伤诱导脂肪酸转运酶CD36从细胞质转移到细胞膜上,并证明SNARE蛋白STX11及其动态棕榈酰化在这一过程中起关键作用。棕榈酰化可释放 STX11 的封闭构象,促进 STX11/SNAP23/VAMP4 SANRE 复合物的形成,从而介导 CD36 和 STX11 的囊泡的融合,从而将CD36转运到细胞膜上。限制脂肪酸的供应、阻止脂肪酸的摄取或抑制 STX11 棕榈酰化都会减弱肌肉再生。作者同时鉴定出了STX11的棕榈酰化酶DHHC20以及去棕榈酰化酶ABHD17A。肌肉损伤分泌的IGF1使ABHD17A失去活性,从而使STX11的棕榈酰化程度升高,促进了CD36的上膜以及脂肪酸的吸收。
该研究揭示了脂肪酸在肌肉再生中的关键作用以及肌肉干细胞中的脂肪酸吸收调控机制,提出了脂肪酸在肌肉损伤后的潜在作用及治疗策略。
复旦大学代谢与整合生物学研究院青年副研究员王娟,博士生李东林为该论文的共同第一作者,赵同金教授为本研究的通讯作者。同时,该课题获得了李蓬院士,周海梦教授和复旦大学杜兴荣,叶浩彬和黄河课题组的大力支持。
原文链接:
https://authors.elsevier.com/a/1iOv%7E_Yv6zuonl
参考文献:
Pepino, M.Y., Kuda, O., Samovski, D., and Abumrad, N.A. (2014). Structure-function of CD36 and importance of fatty acid signal transduction in fat metabolism. Annu Rev Nutr 34, 281-303. 10.1146/annurev-nutr-071812-161220.
Su, X., and Abumrad, N.A. (2009). Cellular fatty acid uptake: a pathway under construction. Trends Endocrinol Metab 20, 72-77. 10.1016/j.tem.2008.11.001.
Kazantzis, M., and Stahl, A. (2012). Fatty acid transport proteins, implications in physiology and disease. Biochim Biophys Acta 1821, 852-857. 10.1016/j.bbalip.2011.09.010.
Chakkalakal, J.V., Jones, K.M., Basson, M.A., and Brack, A.S. (2012). The aged niche disrupts muscle stem cell quiescence. Nature 490, 355-360. 10.1038/nature11438.
Wosczyna, M.N., and Rando, T.A. (2018). A Muscle Stem Cell Support Group: Coordinated Cellular Responses in Muscle Regeneration. Dev Cell 46, 135-143. 10.1016/j.devcel.2018.06.018.
Hong, X., Isern, J., Campanario, S., Perdiguero, E., Ramirez-Pardo, I., Segales, J., Hernansanz-Agustin, P., Curtabbi, A., Deryagin, O., Pollan, A., et al. (2022). Mitochondrial dynamics maintain muscle stem cell regenerative competence throughout adult life by regulating metabolism and mitophagy. Cell Stem Cell 29, 1298-1314 e1210. 10.1016/j.stem.2022.07.009.




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台