
神经退行性疾病(Neurodegenerative disease, ND)是一种异质性疾病,其中多种有害因素导致神经元和大脑的结构或功能丧失,导致认知或运动能力的下降。在实验性自身免疫性脑脊髓炎(Experimental autoimmune encephalomyelitis, EAE)和多发性硬化症(Multiple sclerosis, MS)中,中枢神经系统驻留髓样细胞与免疫系统之间的相互作用在促进ND疾病进展中发挥着重要作用1-3。神经免疫连接在神经退行性疾病中发挥着核心作用,但目前仍然缺乏ND中外周免疫细胞、神经元、小胶质细胞和星形胶质细胞之间直接联系的重要证据。而且,中枢神经系统和外周免疫细胞相互作用的分子机制仍然大多未知。
ADP核糖基化因子1(ARF1)属于Ras小GTPase家族成员,在调节细胞内蛋白质和脂质分选和运输等多种生物过程中发挥重要的分子开关作用4-6。团队前期发现敲除ARF1的神经元促进了小鼠脊髓和后脑中过氧化脂质、脂滴和ATP的积累,并导致神经炎症、脱髓鞘和神经变性。并且,团队还检测到肌萎缩侧索硬化症和多发性硬化症患者脑组织中 ARF1 的减少7。然而,ARF1缺失与中枢神经系统和外周免疫细胞的机制间的关系仍然未知。
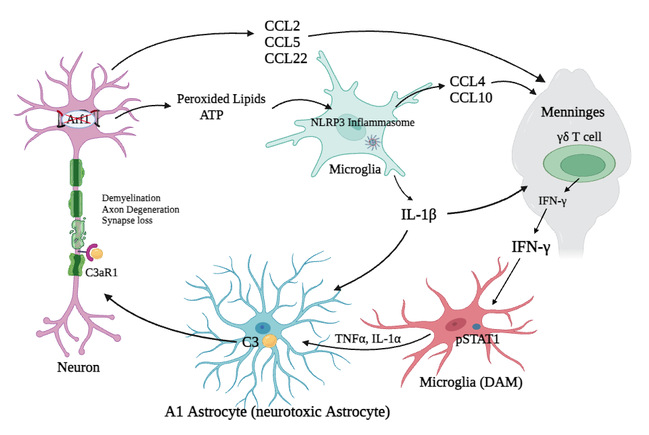
2024年1月17日,复旦大学侯宪玉研究团队题为A Neuron-Immune Circuit Regulates Neurodegeneration in the Hindbrain and Spinal cord of ARF1-Ablated Mice的研究论文在National Science Review杂志发表见刊。研究以神经元中敲除ARF1诱导的神经退行小鼠为模型,解析了激活的小胶质细胞招募并激活脑膜中的γδ T细胞,γδ T细胞分泌IFN-γ进一步激活小胶质细胞-A1星形胶质细胞-C3-神经元C3aR神经毒性通路。本研究将中枢神经系统与外周免疫细胞连接起来,进一步揭示了促进神经退行性疾病发生的研究机制,并证明了ARF1缺失诱导的神经免疫-IFN-γ-胶质细胞病变通路在人类神经退行疾病中存在,尤其是在肌萎缩性脊髓侧索硬化症和多发性硬化症中得以体现。

作者首先发现在小鼠后脑和脊髓神经元中特定敲除ARF1基因会通过释放过氧化脂质和ATP,激活小胶质细胞中的NLRP3炎症小体-IL-1β以及反应性星形胶质细胞。为了检测IFN-γ在介导ARF1敲除小鼠在神经退行通路中的潜在作用,作者检测了IFN-γ缺失背景下ARF1敲除小鼠(ARF1-/-IFN-γ-/-)的表型,发现与 ARF1敲除小鼠(ARF1-/-)相关的行为学异常、突触缺失、轴突脱髓鞘和轴突变性在 IFN-γ 缺失后几乎完全受到抑制,并且在 ARF1 敲除小鼠中,A1型反应性星形胶质细胞和补体 C3 显著增加。说明IFN-γ是ARF1敲除诱导的神经退行性通路的主要下游成分,在过氧化脂质-小胶质细胞NLRP3炎症小体-IL-1β通路的下游起作用,并可能激活A1星形胶质细胞-C3通路以破坏神经元。
随后作者检测到趋化因子CCL2, CCL3, CCL4, CCL5, CCL20, CCL22, and CXCL10和IL-1β被招募并激活脑膜中的γδ T细胞,分泌出进入脑实质的IFN-γ,进而激活小胶质细胞。同时,神经元ARF1敲除小鼠的神经退行表型在IFN-γ或C3基因敲除的情况下得到了明显缓解。作者进一步证明,敲除 IFN-γ、Rag1 和 C3后,ARF1 敲除小鼠的神经退行表型得到了显著改善。此外,VLA-4、γδ T 细胞受体和 IFN-γ 的中和抗体也显著挽救了突变表型。同时,作者也证明了IFN-γ能够激活小胶质细胞中的STAT1通路。
作者之前观察到了神经元ARF1敲除小鼠大脑中星形胶质细胞和 C3 蛋白的变化,于是团队进一步构建出C3缺失背景下ARF1敲除小鼠(ARF1-/-C3-/-)缺陷小鼠,发现C3缺失显著抑制了ARF1敲除小鼠的部分神经退行表型,包括部分行为学异常,星形胶质细胞活化和髓鞘形成相关蛋白的减少。然而,C3缺失并没有抑制ARF1敲除小鼠的一些神经退行表型,包括小胶质细胞活化和IFN-γ,TNF和IL-1α的诱导。作者使用TNF和IL-1β处理星形胶质细胞,发现TNF和IL-1β可显著增加C3的表达水平。这些数据共同表明,C3可能在活化小胶质细胞IFN-γ,TNF和IL-1β的下游,星形胶质细胞中起作用。
作者进一步探究了星形胶质细胞分泌的C3蛋白的神经元毒性。团队首先用 TNF 和 IL-1β处理的星形胶质细胞,收集星形胶质细胞条件培养基(ACM)培养小鼠脑神经瘤细胞N2a细胞。TNF 和 IL-1β处理的星形胶质细胞增加了 C3 表达水平。为了模拟生理条件,作者使用原代神经元和星形胶质细胞重复了上述实验,发现 ACM 也促进神经元死亡。团队还对小鼠脊髓和原代培养的神经元和小胶质细胞中的C3a受体(C3aR1)进行了表征,发现C3aR1在神经元表面表达,CD11b主要存在于小胶质细胞中。接下来,作者将纯化的 C3 蛋白添加到神经元的培养基中,这也诱导了培养的原代神经元的死亡。此外,作者发现神经元中的C3aR1敲低可以挽救ACM诱导的神经元死亡,通过添加C3抗体消除C3可以减少ACM诱导的神经元死亡。团队还向野生型小鼠的脊髓鞘内注射TNF、IL-1β和 C3,结果表明TNF+IL-1β和C3均能诱导脱髓鞘、突触丢失和神经元死亡。单次注射TNF和IL-1β可诱导星形胶质细胞激活,单次注射C3可部分激活小胶质细胞。这些结果表明,C3-C3aR1 通路介导ARF1敲除小鼠中激活的 A1 星形胶质细胞的神经毒性功能,激活的星形胶质细胞促进神经元死亡。最后,作者证明ARF1缺失诱导的神经免疫 IFN-γ神经胶质增生途径存在于人类ND尤其是在ALS和MS中。
综上所述,本研究以神经元中敲除ARF1诱导的神经退行小鼠为模型,解析了激活的小胶质细胞招募并激活脑膜中的γδ T细胞,γδ T细胞分泌IFN-γ进一步激活小胶质细胞-A1星形胶质细胞-C3-神经元C3aR神经毒性通路,并在神经退行病人的样本中进行了验证。这些发现揭示了一个前所未有的免疫回路,该回路连接神经元-小胶质细胞-外周免疫细胞-星形胶质细胞-神经元以促进神经退行性变。本研究将神经退行疾病与免疫反应连接起来,有望为神经退行治疗提供新策略。
原文链接:
https://doi.org/10.1093/nsr/nwad222
参考文献:
Lee HG, Wheeler MA, Quintana FJ. Function and therapeutic value of astrocytes in neurological diseases. Nat Rev Drug Discov. 2022; 21(5): 339-358. doi: 10.1038/s41573-022-00390-x.
Rodríguez Murúa S, Farez MF, Quintana FJ. The Immune Response in Multiple Sclerosis. Annu Rev Pathol. 2022; 17: 121-139. doi: 10.1146/annurev-pathol-052920-040318.
Bao L, Bo XC, Cao HW et al. Engineered T cells and their therapeutic applications in autoimmune diseases. Zool Res. 2022; 43(2): 150-165. doi: 10.24272/j.issn.2095-8137.2021.363.
B. Kaczmarek, J. M. Verbavatz, C. L. Jackson. GBF1 and ARF1 function in vesicular trafficking, lipid homoeostasis and organelle dynamics. Biol Cell 2017; 109:391-399.
J. G. Donaldson, C. L. Jackson. ARF family G proteins and their regulators: roles in membrane transport, development and disease. Nat Rev Mol Cell Biol 2011; 12:362-375.
C. D'Souza-Schorey, P. Chavrier. ARF proteins: roles in membrane traffic and beyond. Nat Rev Mol Cell Biol 2006; 7:347-358.
Wang, Guohao et al. “Neuronal accumulation of peroxidated lipids promotes demyelination and neurodegeneration through the activation of the microglial NLRP3 inflammasome.” Nature aging 2021;1024-1037.




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台