
肝癌是我国发病率最高的恶性肿瘤之一,其死亡率在恶性肿瘤中位列第二。我国是肝癌大国,每年全球超过50%新发病例在我国。我国肝癌患者预后普遍较差,五年总体生存率仅为10%,肝癌早期发生和复发监测困难,临床治疗手段单一、患者预后差是严重影响我国肝癌患者生存时间和存活质量的瓶颈问题。微器官(mini-organ)/类器官(Organoid)是一种3D(三维)细胞培养系统,其与体内来源组织或器官高度相似,是疾病机理研究和药物筛选的理想平台。
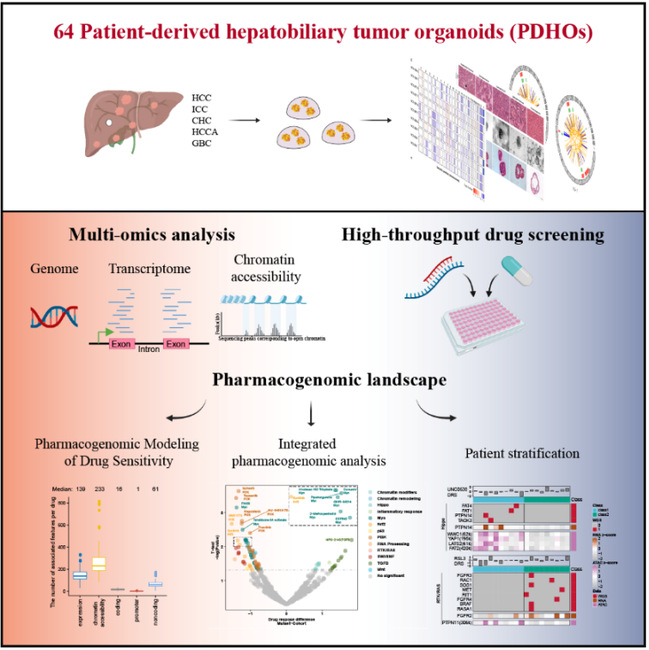
近日,海军军医大学/复旦大学代谢与整合生物学研究院王红阳院士及其合作团队在Cell Reports Medicine在线发表了题为Integrated Characterization of Hepatobiliary Tumor Organoids Provides a Potential Landscape of Pharmacogenomic Interactions的研究论文。研究者基于中国肝病人群的基因变异谱和遗传特点,自主设计并优化完善了肝胆系统肿瘤类器官/微器官规模化培养系统,成功构建了64例肝胆系统肿瘤类器官(patient-derived hepatobiliary tumor organoids,PDHOs)模型,并对其完成了包括全基因组、转录组、ATAC-seq、非靶向代谢组的多组学检测,建立了人体肝病类器官多组学大数据应用平台,并进一步整合多组学测序和高通量药物筛选探索了基于人源肿瘤类器官的肝胆系统肿瘤药物基因组学研究。
该研究利用临床手术切除的肿瘤组织为主要来源,成功构建了基于中国肝胆疾病人群的包括正常肝、肝癌、胆管癌、胆囊癌的64例肝胆系统肿瘤类器官模型,并对其完成了包括全基因组、转录组、ATAC-seq、非靶向代谢组的多组学检测,建立了人体肝病类器官多组学大数据应用平台。进一步,研究者建立了基于人源肿瘤类器官的高通量药物筛选和疗效评估体系,选取了301种抗肿瘤药物开展了类器官药物筛选的研究。结合多组学整合的大规模药物筛选揭示了64 种临床相关药物的超过 32,000种基因组-药物相互作用,包括编码、启动子、非编码突变、表达特征和染色质可及性。研究者通过以pathway的角度,将基因组、转录组、表观遗传组等多组学数据相整合,开发了一套可以识别遗传特征与药物敏感性最佳组合的数理模型。总之,综合药物基因组分析举例说明了如何使用大规模多组学测序来增强生物研究的能力,并为选定的癌症亚群确定潜在的治疗选择。
原文链接:
https://doi.org/10.1016/j.xcrm.2023.101375




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台