
肥胖和糖尿病是最典型的两大代谢疾病,其发病广、危害大,同时是癌症、心血管、神经等疾病重要诱发因素。目前,我国肥胖和糖尿病的发病人群迅速增加,虽然近年来新型肠促胰素类药物的问世和代谢手术的普及缓解了临床的治疗窘迫,然而开发副作用小、疗效持久、安全有效的治疗方法仍具备挑战性。下丘脑作为机体的稳态控制中心,通过多种途径参与糖代谢和脂代谢的调节,是影响肥胖和糖尿病发生发展的关键脑区1。然而,下丘脑含有众多功能核团,其异质性和复杂性限制了靶向中枢的代谢药物开发。目前下丘脑不同核团和细胞类型如何感应营养信息,响应糖脂代谢变化,并维持代谢稳态的精确分子机制仍不明确。同时,基于啮齿类动物的肥胖和糖尿病模型与临床代谢疾病仍有较大差异,发现种属特异性分子和代谢变化成为临床疾病诊疗的重要突破口。
2024年2月6日,复旦大学生命科学学院/代谢与整合生物学研究院刘铁民、孔星星课题组,复旦大学生命科学学院张智课题组与华大生命科学研究院刘石平和徐讯团队合作,在Cell Metabolism杂志发表了题为Region-specific transcriptomic responses to obesity and diabetes in macaque hypothalamus的研究论文。该研究以灵长类食蟹猴为模型,首次系统性阐述了肥胖和糖尿病两种不同代谢疾病下,灵长类下丘脑的空间转录组学响应,利用单细胞核RNA测序和空间转录组测序技术,直接检测了481,802个个体细胞中的多个分子标志物,揭示了肥胖和糖尿病对食蟹猴下丘脑的不同脑区、多种细胞类型的空间分子改变。研究结果助于深入了解不同疾病的代谢紊乱机制。

这项研究发现,受肥胖和糖尿病影响最强烈的脑区为下丘脑弓状核(Infundibular,INF,也称漏斗核)。其中相比于肥胖,糖尿病在各个细胞类型中呈现更强烈的转录水平变化。下丘脑室旁核(Paraventricular nuclei, PVN)中的转录变化主要在糖尿病中被发现,提示了室旁核在葡萄糖响应和血糖调控中的关键作用2。此外,尽管弓状核和室旁核神经元对代谢功能紊乱最为敏感,但它们在对糖尿病的响应上显示出了不同的分子变化。具体而言,弓状核神经元呈现出升高的炎症免疫反应网络,并涉及多种细胞类型,而室旁核则显示出抑制性细胞代谢和活动。因此,这些结果提供了直接的分子证据,准确定位了弓状核神经元-室旁核回路在维持能量平衡中的重要作用3,并强调了这两个核团对于开发更有针对性的代谢紊乱治疗方法的差异性响应。
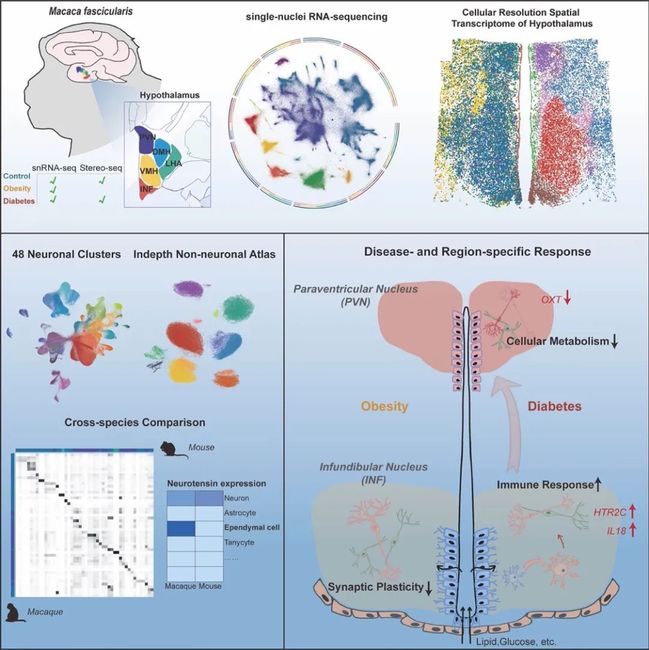
除了与代谢调节相关的已知基因外,研究团队还发现了在灵长类动物中可能与代谢调节相关的显著基因和通路,包括干扰素通路、OXT神经元中的ATP代谢级联通路、伸展细胞中的纤毛组织形成,以及小胶质细胞中的IL18和免疫防御反应。例如,神经肽降压素(Neurotensin,NTS)是一种与能量代谢相关的多功能神经肽4,已在啮齿动物神经元中发现5,而该研究发现在灵长类动物中,降压素在仅限于灵长类动物的室管膜细胞中表达,肥胖时降压素的减少可能意味着降压素作为一种细胞间调节因子在大脑中循环,支持了其在代谢调节中的潜在调控作用。总之,本研究提供了一个全面的灵长类下丘脑单细胞和空间基因表达图谱,揭示了肥胖和糖尿病对下丘脑的差异性转录变化。这些发现不仅为研究下丘脑的代谢调控功能提供了丰富资源,有助于更好地理解代谢疾病发生的机制,也能够为肥胖和糖尿病提供更精确、有效的治疗策略。
复旦大学生命科学学院/代谢与整合生物学研究院刘铁民教授、孔星星教授,复旦大学生命科学学院张智副研究员,华大生命科学研究院刘石平研究员、徐讯研究员为论文共同通讯作者,华大生命科学研究院雷莹研究员、复旦大学人类表型组研究院博士生梁宪、中国科学院大学博士生孙雨浓、西安交通大学基础医学院姚婷副教授、内蒙古大学生命科学学院博士生宫红玉为共同第一作者。同时,该课题获得了中国科学院遗传与发育生物学研究所吴青峰教授、荷兰阿姆斯特丹大学易春霞教授、复旦大学于淼研究员、南京医科大学高原青教授和上海体育大学王茹教授的大力支持。
原文链接:
https://www.cell.com/cell-metabolism/fulltext/S1550-4131(24)00003-2
参考文献:
Maroso M, Stern P. Small and mighty: The hypothalamus. Science 382, 386-387 (2023).
Stanley S, Moheet A, Seaquist ER. Central Mechanisms of Glucose Sensing and Counterregulation in Defense of Hypoglycemia. Endocr Rev 40, 768-788 (2019).
Liu T, Xu Y, Yi C-X, Tong Q, Cai D. The hypothalamus for whole-body physiology: from metabolism to aging. Protein & Cell, (2021).
Li J, et al. An obligatory role for neurotensin in high-fat-diet-induced obesity. Nature 533, 411-415 (2016).
Schroeder LE, et al. Mapping the populations of neurotensin neurons in the male mouse brain. Neuropeptides 76, 101930 (2019).




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台