
能量代谢是生命最基本的特征之一,包括能量摄入和能量消耗两个方面,棕色脂肪是其中重要的产热器官【1】。当充分激活时,棕色脂肪组织可以使小鼠的全身能量消耗成倍增加,使人体的能量消耗增加40-80%【2】。在环境温度的某一范围内,机体代谢率最低且不随环境温度而变化,该温度范围为热中性区(Thermal neutral zone,TNZ)。为了避免体温过高,机体会通过降低代谢的方式减少自身的产热,使棕色脂肪失去其产热能力。由于人体常年生活于最适宜的环境温度,棕色脂肪从出生后就不断退化,而能量代谢则维持在最低水平,增加代谢类疾病的患病风险。此外,衰老相关的代谢问题,比如基础代谢率下降、体脂增加、胰岛素抵抗等,可能与棕色脂肪活性降低有关。研究热中性环境下小鼠的代谢特征可以更好的模拟、理解人棕色脂肪的功能和代谢活动规律【3】。保留或恢复人棕色脂肪代谢能力,有助于确定治疗肥胖或糖尿病的新靶点。
PGC1α属于转录调节因子家族,可作为多种转录因子的共激活因子,在调节细胞能量代谢中发挥着重要作用【4】。PGC1α在高度氧化的组织中高表达,如棕色脂肪、骨骼肌、肝脏等器官,其被激活后可诱导和协调产热相关基因的表达上调,是生命体内多种生理功能的主要执行者【5】。PGC1α水平失调与多种疾病的发病机制有关,如糖尿病、肥胖症、心脏病和神经系统疾病等【6】。PGC1α会被泛素化修饰,并随后被蛋白酶体降解【7】。PGC1α是一种半衰期较短的蛋白质,蛋白合成和降解之间的平衡决定其细胞内的表达水平。除泛素化以外,蛋白还会通过其他方式被降解,如自噬途径等。目前,尚未有研究报道PGC1α会通过其他方式被降解。
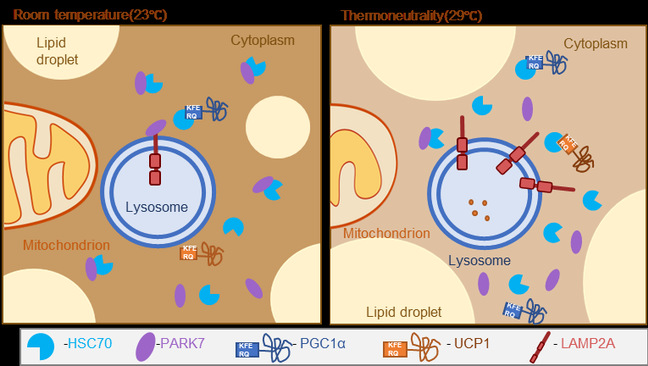
近日,复旦大学生命科学学院/代谢与整合生物学研究院孔星星团队及合作者在Nature Communication期刊上发表了一篇题为“Chaperone-mediated autophagy manipulates PGC1α stability and governs energy metabolism under thermal stress”的论文,该研究指出在热中性环境下,PGC1α不通过常规已知的泛素化通路降解,而是通过分子伴侣自噬(Chaperone-mediated autophagy,CMA)降解。又发现帕金森蛋白7(Parkinson Disease Protein 7, PARK7)能与LAMP2A及CMA中重要的分子伴侣HCS70竞争性结合,通过PARK7在不同温度环境下表达量的不同调控CMA的活性的新分子机制。

作者首先通过在细胞热刺激条件下的实验发现,PGC1α不通过常规已知的泛素化通路降解,而是通过CMA降解。进一步对PGC1α的CMA识别序列-KFERQ基序进行预测及突变后,确定了其存在2个可以被CMA识别的基序,并且在突变该基序后PGC1α无法进入溶酶体进行降解。在小鼠棕色脂肪敲低Lamp2a能够缓解热中性环境下的肥胖表型,并且增加线粒体活性以及PGC1α和UCP1在棕色脂肪中的表达量。
为了探究CMA在热中性条件下的激活机制,作者通过LAMP2A IP-MS,LAMP2A结合蛋白预测和不同温度下小鼠棕色脂肪蛋白质组学三个数据库的交集发现了PARK7。进一步体内实验证明,LAMP2A和PARK7会竞争结合HSC70从而调控CMA活性。在棕色脂肪中特异性敲除Park7的小鼠在热中性环境下会出现更加严重的肥胖表型,线粒体受损;而同时敲低Lamp2a则可以缓解其肥胖并恢复线粒体功能。
本研究首次揭示CMA在维持棕色脂肪组织能量稳态中的核心作用。证实PARK7通过调控LAMP2A与HSC70的分子互作,动态调节CMA活性,进而改变棕色脂肪关键产热蛋白的表达水平。这一发现为破解成年人棕色脂肪功能衰退难题以及衰老对棕色脂肪的调控提供了全新干预靶点,为代谢性疾病治疗策略开发注入创新动能。
复旦大学生命科学学院博士庄乙潇、复旦大学人类表型组研究院博士生张昕熠、复旦大学生命科学学院博士后张爽、中科院有机所博士现南方科技大学博士后孙云鹏为该论文共同第一作者。复旦大学生命科学学院/代谢与整合生物学研究院孔星星教授、生命科学学院金力教授和高焕庆青年副研究员为该论文共同通讯作者。感谢南京医科大学基础医学院李仲教授和复旦大学代谢与整合生物学研究院许毅青年研究员等专家学者为本研究提供的帮助和建议。
原文链接:https://www.nature.com/articles/s41467-025-59618-0
参考文献:
1.Zeng, W., et al., Sympathetic neuro-adipose connections mediate leptin-driven lipolysis [J]. Cell, 2015. 163(1): 84-94.
2.Ouellet, V., et al., Brown adipose tissue oxidative metabolism contributes to energy expenditure during acute cold exposure in humans [J]. J Clin Invest, 2012. 122(2): 545-52.
3.Fischer, A.W., B. Cannon, and J. Nedergaard, Optimal housing temperatures for mice to mimic the thermal environment of humans: An experimental study [J]. Mol Metab, 2018. 7: 161-170.
4.Puigserver, P., et al., Activation of PPARgamma coactivator-1 through transcription factor docking [J]. Science, 1999. 286(5443): 1368-71.
5.Kong X, et al IRF4 is a key thermogenic transcriptional partner of PGC-1α[J]. Cell. 2014. 158(1):69-83.
6.Finck, B.N. and D.P. Kelly, PGC-1 coactivators: inducible regulators of energy metabolism in health and disease [J]. J Clin Invest, 2006. 116(3): 615-22.
7.Luo, X., et al., Posttranslational regulation of PGC-1α and its implication in cancer metabolism [J]. Int J Cancer, 2019. 145(6): 1475-1483.




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台