
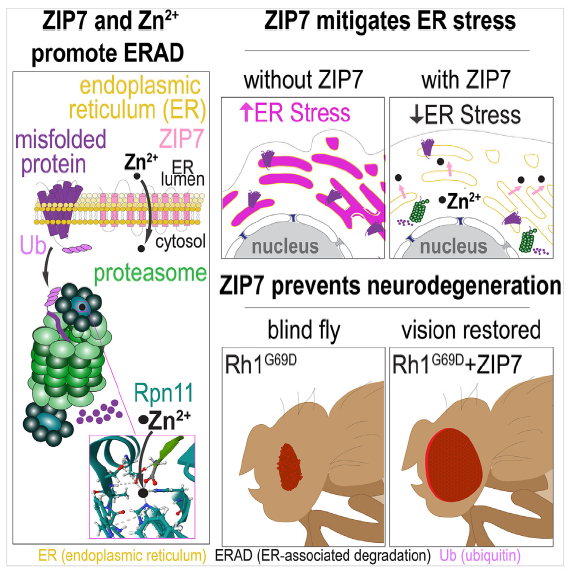
错误折叠的蛋白会引起细胞内的蛋白毒性应激。细胞可以通过内质网相关蛋白降解(ERAD)等途径清除错误折叠的蛋白。然而,持续的应激压力可能导致细胞凋亡,这是多种由蛋白折叠错误诱发的神经退行性疾病的基本机制。因此,增强ERAD成为治疗蛋白毒性应激相关疾病的一种有前景的方法。【1】
2024年4月25日,美国加州大学圣塔芭芭拉分校和复旦大学代谢与整合生物学研究院等单位的研究人员在Developmental Cell在线发表了题为“The Zn2+ transporter ZIP7 enhances endoplasmic-reticulum-associated protein degradation and prevents neurodegeneration in Drosophila”的论文。研究发现,ZIP7介导的锌离子转运可以增强蛋白酶体中锌离子依赖的金属蛋白酶Rpn11的活性,Rpn11活性的提高可以促进外来蛋白质进入蛋白酶体时的去泛素化过程,从而增强了对错误折叠蛋白质的降解。

定位于内质网的锌离子转运蛋白ZIP7在从植物到人类的多种生物中都是保守的,其参与了包括细胞存活和迁移等生物学过程,但是不同表型背后的统一机制尚不清楚【2】。在研究果蝇卵室中边界细胞(border cell)迁移时,研究人员发现ZIP7突变的细胞表现出更高的内质网应激。有趣的是,过表达ZIP7可以减缓由错误折叠蛋白引发的内质网应激以及细胞迁移受阻,这表明ZIP7在ERAD中扮演着重要的调控作用。
那么ZIP7是如何影响ERAD的呢?已知和ERAD相关的锌离子结合蛋白包括一些泛素连接酶【3】,以及蛋白酶体的盖子结构中的去泛素化酶Rpn11【4】。通过对ZIP7过表达和敲降的果蝇卵室中蛋白质多泛素化水平的检测,研究人员发现ZIP7增强了果蝇中蛋白质的去泛素化水平。在哺乳动物细胞的实验中,进一步证明了提高细胞质锌离子浓度或过表达ZIP7能增强蛋白质的去泛素化水平,提示ZIP7通过增强Rpn11介导的去泛素化,从而帮助错误折叠蛋白进入蛋白酶体降解。
最后,研究人员在果蝇视网膜模型中验证了过表达ZIP7对缓解由错误折叠蛋白导致的视网膜病变和恢复视力的作用。在这项研究的基础上,研究人员申请了利用激活ZIP7来治疗神经退行性疾病的相关专利,希望能够将从模式动物的基础研究转化到人类疾病的治疗。
美国加州大学圣塔芭芭拉分校的Denise Montell院士和复旦大学代谢与整合生物学研究院的戴薇青年研究员为该论文的共同通讯作者。该研究工作得到了美国NIH基金和国家自然科学基金等相关科研项目的资助。
原文链接:
https://doi.org/10.1016/j.devcel.2024.04.003
参考文献:
Njomen, E., and Tepe, J.J. (2019). Proteasome activation as a new therapeutic approach to target proteotoxic disorders. J. Med. Chem. 62, 6469–6481.
Ohashi, W., Kimura, S., Iwanaga, T., et al. (2016). Zinc transporter SLC39A7/ZIP7 promotes intestinal epithelial self-renewal by resolving ER stress. PLoS Genet. 12, e1006349.
Xu, J., Zhao, H., and Wang, T. (2020). Suppression of retinal degeneration by two novel ERAD ubiquitin E3 ligases SORDD1/2 in Drosophila. PLoS Genet. 16, e1009172.
Snyder, N.A., and Silva, G.M. (2021). Deubiquitinating enzymes (DUBs): regulation, homeostasis, and oxidative stress response. J. Biol. Chem. 297, 101077.




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台