
在人类历史的长河中,追求长寿一直是一个永恒的话题。从古代的炼丹求仙,到现代的科学探索,人们对长寿的渴望从未停歇。然而,尽管目前科学家已鉴定出超过800个潜在能够影响长寿的基因[1],如何延缓衰老或延长生物体的健康寿命仍是一个亟待攻克的难题,并被Science杂志列为125个最具挑战的科学问题之一[2]。溶酶体作为细胞的降解与信号整合中心[3],其功能衰退被认为是衰老和衰老相关神经退行性疾病发生的核心机制之一,但如何系统性地增强溶酶体功能并使机体在健康或长寿方面获益,目前相关研究仍然十分有限。
2025年6月26日,复旦大学代谢与整合生物学研究院李阳Terytty课题组与瑞士洛桑联邦理工学院(EPFL)Johan Auwerx 团队合作,在Nature Cell Biology杂志发表题为 “A lysosomal surveillance response to stress extends healthspan”的研究论文。该工作以秀丽隐杆线虫为主要实验对象,首次揭示了一条旨在维护或增强溶酶体功能的长寿应激通路——溶酶体监察反应(Lysosomal Surveillance Response,即LySR)。研究发现,LySR通路可由沉默特定基因(如vha-6)激活,通过对溶酶体的一系列积极作用,延长生物体平均寿命约60%,同时可有效清除阿尔茨海默病(AD)、亨廷顿舞蹈症(HD)和渐冻症(ALS)的动物模型中致病蛋白的积聚,改善运动、记忆力等健康指标,为健康寿命延长及衰老相关神经退行性疾病的干预提供了全新的策略。

李阳Terytty团队先前围绕线粒体应激反应(MSR)取得了一系列重要的科研成果[4-6]。在此过程中,他们意外发现,利用RNAi的方法敲低v-ATPase质子泵的某些亚基,如vha-6、vha-8等,居然可以和激活MSR一样非常显著地增加线虫的寿命,比如,效果最好的vha-6 RNAi可以增加线虫接近70%的平均寿命(图1)。但同时,也有几个v-ATPase亚基的RNAi, 比如vha-16和vha-19,它们的处理则缩短了线虫的寿命(图1)。转录组学分析显示,有760个基因特异地在长寿组(vha-6 RNAi处理)线虫中出现了高表达。非常有趣的是,这760个基因显著地聚类于溶酶体、蛋白质水解等信号通路。研究团队将这类可以由敲低vha-6等刺激信号引起的,可以显著增加溶酶体与蛋白质水解相关基因表达,并与长寿相关联的这个现象命名为LySR, 即“溶酶体监察反应”。
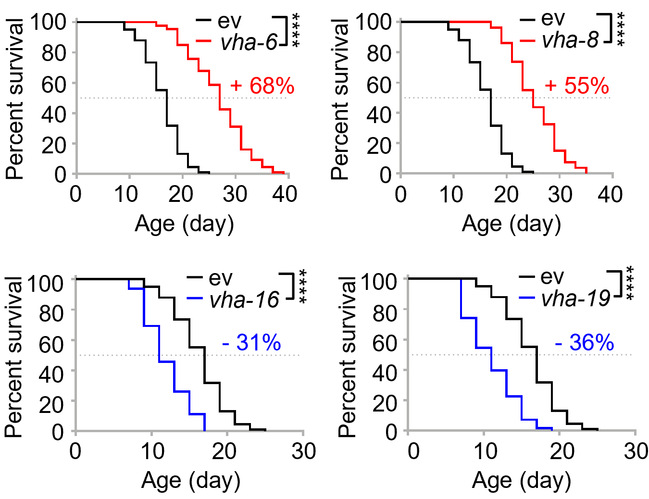
图1 不同v-ATPase亚基的RNAi对线虫寿命的影响
研究团队发现,由vha-6 RNAi等引起的寿命延长的现象,独立于多种已知的经典长寿通路。进一步研究表明,与VHA-16、VHA-19等定位于溶酶体表面的蛋白不同[5],vha-6基因的表达产物VHA-6特异地定位于线虫肠道细胞靠近肠腔一侧的膜表面,作为特化的v-ATPase复合体成员参与肠腔的酸化,其表达干预改变了肠腔的pH环境,继而引起了适应性应激反应LySR的激活。分子机制上,GATA转录因子家族成员ELT-2被鉴定为LySR通路的关键调控因子。通过生信分析和ChIP-qPCR等实验验证,ELT-2可以直接结合近40%的LySR基因的启动子区域,并在组蛋白乙酰转移酶CBP-1介导的H3K27乙酰化修饰协同下,驱动LySR通路的全面激活(图2)。此外,卡路里限制、β淀粉样蛋白积聚等刺激也可以引起LySR通路的部分激活。
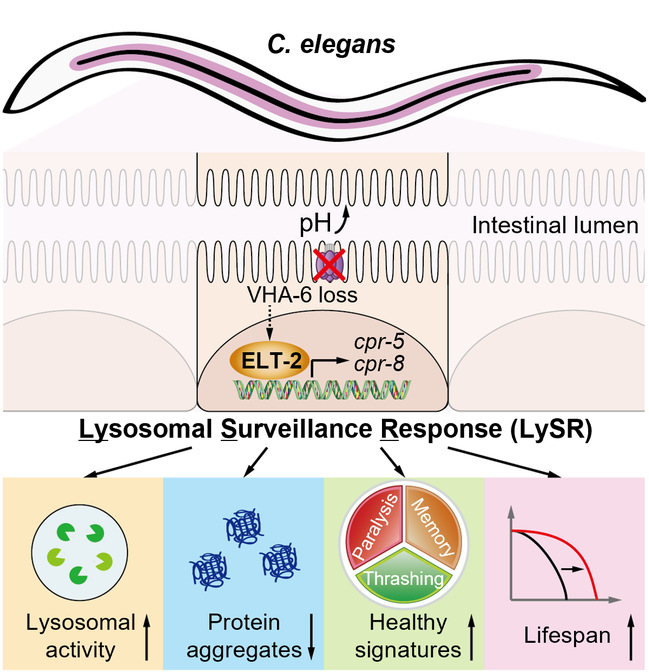
图2 溶酶体监察反应LySR的调控机制与功能
除了理论突破之外,LySR通路在AD、HD、ALS等神经退行性疾病模型中也展示出了强大的转化潜力。团队发现,vha-6 RNAi引起的LySR的激活可以大幅地清除AD、HD、ALS等疾病相关的致病蛋白聚集物的积累,并显著改善生物体运动、记忆力等健康指标。而这一过程又高度地依赖于此时溶酶体活力的增强和蛋白水解酶CPR-5的高表达。有意思的是,肠细胞表达的溶酶体蛋白酶CPR-5还可被分泌至体腔被其他组织吸收,从而潜在发挥跨组织蛋白质稳态调节的功能。值得一提的是,CPR-5在哺乳动物中的同源物组织蛋白酶B (Cathepsin B,CTSB)不仅参与了多种溶酶体底物的清除[7-9],还可以被分泌到胞外和血浆中,发挥组织环境重塑、免疫炎症传导和认知功能改善等作用[10,11]。
“我们的研究表明,溶酶体并非被动的降解机器,而是具备动态监视和适应性调节能力的智能系统。”李阳Terytty青年研究员指出,“激活LySR通路可能成为‘一石二鸟’的策略——既延缓正常衰老延长寿命,又遏制蛋白毒性疾病的进展。” 目前,团队正在哺乳动物模型中验证LySR通路的保守性,并探索小分子化合物激活ELT-2或CPR-5的可能性。总之,该项研究不仅加深了人类对于溶酶体稳态调控与长寿机制的理解,更有望为推动 “溶酶体医学” 领域的跨越式发展,开发抗衰老药物和神经退行性疾病的新疗法奠定基础。
复旦大学代谢与整合生物学研究院李阳Terytty青年研究员和EPFL的Johan Auwerx教授为文章的共同通讯作者。李阳Terytty青年研究员、Arwen W. Gao博士、杨仁丹博士研究生、孙玉博士为论文共同第一作者。复旦大学代谢与整合生物学研究院为第一完成单位。
原文链接:
https://doi.org/10.1038/s41556-025-01693-y
参考文献:
Campisi, J. et al. From discoveries in ageing research to therapeutics for healthy ageing. Nature 571, 183-192 (2019).
Settembre, C. & Perera, R.M. Lysosomes as coordinators of cellular catabolism, metabolic signalling and organ physiology. Nat Rev Mol Cell Bio 25, 223-245 (2024).
Li, T.Y. et al. The transcriptional coactivator CBP/p300 is an evolutionarily conserved node that promotes longevity in response to mitochondrial stress. Nat Aging 1, 165-178 (2021).
Li, T.Y. et al. V-ATPase/TORC1-mediated ATFS-1 translation directs mitochondrial UPR activation in C. elegans. J Cell Biol 222 (2023).
Li, T.Y. et al. Lysosomes mediate the mitochondrial UPR via mTORC1-dependent ATF4 phosphorylation. Cell Discov 9 (2023).
Embury, C.M. et al. Cathepsin B Improves -Amyloidosis and Learning and Memory in Models of Alzheimer's Disease. J Neuroimmune Pharm 12, 340-352 (2017).
Liang, Q., Ouyang, X., Schneider, L. & Zhang, J. Reduction of mutant huntingtin accumulation and toxicity by lysosomal cathepsins D and B in neurons. Mol Neurodegener 6, 37 (2011).
Kikuchi, H. et al. Involvement of cathepsin B in the motor neuron degeneration of amyotrophic lateral sclerosis. Acta Neuropathol 105, 462-468 (2003).
Vidak, E., Javorsek, U., Vizovisek, M. & Turk, B. Cysteine Cathepsins and Their Extracellular Roles: Shaping the Microenvironment. Cells-Basel 8 (2019).
Moon, H.Y. et al. Running-Induced Systemic Cathepsin B Secretion Is Associated with Memory Function. Cell Metab 24, 332-340 (2016).




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台