
脂滴是细胞内储存中性脂质的细胞器,在脂稳态调控和疾病发生中扮演着重要的角色,脂滴的生成、融合和生长紊乱可导致代谢性疾病如肥胖、脂肪肝、糖尿病和动脉粥样硬化的发生发展【1,2】。富集于脂滴-脂滴接触位点(lipid droplet contact site,LDCS)的CIDE蛋白已被充分证实介导中性脂从小脂滴(供体)向大脂滴(受体)的转移,进而促进脂滴融合和增大。这类促进中性脂在细胞内的储存是维持脂稳态的重要调节方式【3-5】。然而,源自于内质网的CIDE蛋白如何定位到脂滴的调控机制仍需要进一步探索。
2025年7月3日,复旦大学代谢与整合生物学研究院陈丰荣青年研究员及其合作团队在PNAS杂志上在线发表了题为“PI(4)P recruits CIDE proteins to promote the formation of unilocular lipid droplets during adipogenesis and hepatic steatosis”的研究论文。研究团队通过生物化学、细胞生物学、超分辨影像系统等方法,在细胞和动物水平上,发现脂滴表面的磷脂成分PI(4)P介导了CIDE蛋白募集定位到脂滴上与后续LDCS上的富集与功能作用。脂滴相关的脂质转运蛋白ORP2和ORP5能移除脂滴表面的PI(4)P,显著阻断CIDE蛋白的脂滴定位与功能。通过敲低PI(4)P合成酶基因 PI4K2A 可以阻断脂滴表面 PI(4)P 的合成,并损害CIDE蛋白的脂滴定位和功能。在脂肪细胞中,耗竭PI(4)P会显著减小脂滴体积,并减少脂肪组织的储脂。在严重脂肪变性(steatosis)的肝脏中,PI(4)P的缺失同样抑制了脂滴的扩大。该项研究揭示了脂滴表面磷脂PI(4)P通过介导CIDE蛋白的脂滴定位与功能进而调控体内脂质稳态。

近年来,许多研究表明细胞器表面的磷脂成分对于细胞器的稳态调控起到至关重要的作用【6】。研究团队首先通过在CIDEC-HeLa细胞中过表达ORP2/ORP5发现,细胞中脂滴体积明显减小,数量显著增加;在该细胞中敲低PI4K2A时,同样抑制CIDEC介导的脂滴融合增大功能(图1)。
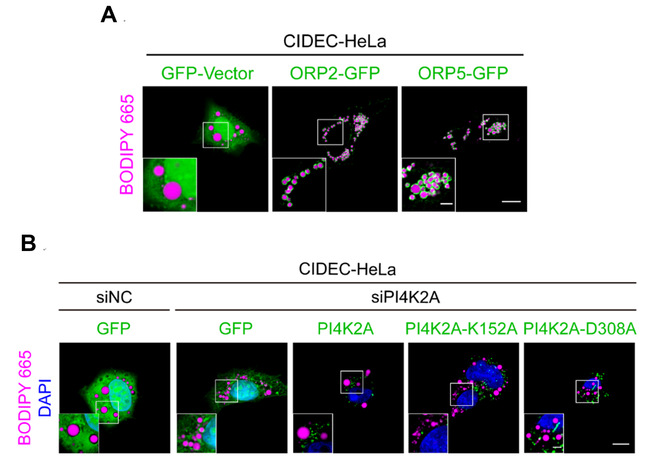
图1:(A)在CIDEC-HeLa细胞中过表达ORP2/ORP5的影像图,结果显示过表达ORP2/ORP5会使得脂滴体积明显减小,数量显著增加。
(B)在CIDEC-HeLa细胞中敲低PI4K2A的影像图,结果显示敲低PI4K2A会使脂滴体积减小,在敲低PI4K2A的基础上回补野生型的PI4K2A
会恢复脂滴增大表型,但回补酶活缺失的PI4K2A突变蛋白(K152A、D308A)不会引起任何脂滴体积变化。
研究团队继续采用lipid strip和giant unilamellar vesicles (GUVs) binding的双重体外实验系统,发现并证实体外纯化的全长CIDEC蛋白与PI(4)P存在直接结合(图2)。在有内源性表达CIDEC的3T3-L1脂肪细胞中过表达ORP2、ORP5或敲低PI4K2A后,会导致脂滴明显减小、数量增多,并且脂解效率升高。当野生型小鼠的皮下白色脂肪组织(iWAT)原位AAV注射使得iWAT原位过表达ORP2、ORP5或敲低PI4K2A后会导致iWAT的重量与储脂含量显著下降。另外,在ob/ob小鼠的肝脏中过表达ORP2、ORP5或敲低PI4K2A后,会使得肝细胞的脂滴储脂方式由单室脂滴转变为多室脂滴的形态。上述结果说明通过ORP2/ORP5过表达或PI4K2A敲低会导致脂肪组织或肝脏内储脂含量显著下降。
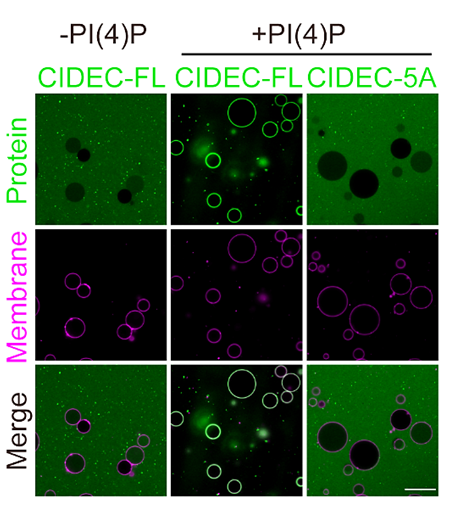
图2:体外GUV binding实验证明PI(4)P与全长CIDEC-GFP蛋白(CIDEC-FL)存在直接结合,
而失去脂滴定位的CIDEC-GFP蛋白突变体(CIDEC-5A)则不再与PI(4)P结合。
综上,这项研究揭示了磷脂转运蛋白ORP2/ORP5或磷脂合成酶PI4K2A通过改变脂滴表面的PI(4)P水平进而调控CIDE蛋白介导的脂滴融合增大功能。当脂滴表面的PI(4)P水平下降时,CIDE蛋白的脂滴定位及其介导的脂质交换/转移速率均显著下降,进而导致细胞内的储脂方式由单室脂滴转为多室脂滴(图3)。
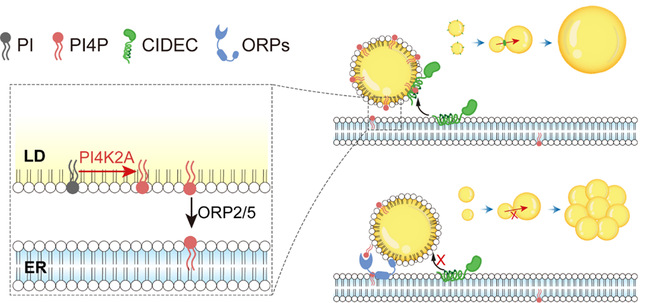
图3:PI(4)P调控CIDE蛋白的脂滴定位与脂滴融合的调控机制图。
复旦大学代谢与整合生物学研究院吴晋博士为该论文的第一作者,复旦大学代谢与整合生物学研究院陈丰荣青年研究员,郑州大学李蓬院士和德克萨斯大学休斯敦健康科学中心杨洪远教授为共同通讯作者,郑州大学天健先进生物医学实验室叶佑丕研究员与复旦大学代谢与整合生物学研究院常春美青年研究员为本研究提供了重要帮助和支持。
原文链接:
https://www.pnas.org/doi/10.1073/pnas.2504219122
参考文献:
Zadoorian, A., Du, X., and Yang, H. (2023) Lipid droplet biogenesis and functions in health and disease. Nat. Rev. Endocrinol. 19, 443-459. https://doi.org:10.1038/s41574-023-00845-0
Wilfling, F., Haas, J. T., Walther, T. C., and Farese, R. V., Jr. (2014) Lipid droplet biogenesis. Curr. Opin. Cell Biol. 29, 39-45. https://doi.org:10.1016/j.ceb.2014.03.008
Zhou, Z. et al. (2003) Cidea-deficient mice have lean phenotype and are resistant to obesity. Nat. Genet. 35, 49-56. https://doi.org:10.1038/ng1225
Gong, J. et al. (2011) Fsp27 promotes lipid droplet growth by lipid exchange and transfer at lipid droplet contact sites. J. Cell Biol. 195, 953-963. https://doi.org:10.1083/jcb.201104142
Lyu, X. et al. (2021) A gel-like condensation of Cidec generates lipid-permeable plates for lipid droplet fusion. Dev. Cell 56, 2592-2606.e2597. https://doi.org:10.1016/j.devcel.2021.08.015
Ebner, M. et al. (2025) Nutrient-regulated control of lysosome function by signaling lipid conversion. Cell 188, 2560. https://doi.org:10.1016/j.cell.2025.04.009




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台