
脂滴是储存中性脂以供细胞活动所需的动态细胞器【1-3】,其生成、生长和降解会根据细胞对能量储存或利用的需求而波动。脂肪降解是甘油三酯(triglycerides,TG)水解成脂肪酸的过程,释放的脂肪酸可进一步被用于产生能量或膜脂合成。传统上,哺乳动物被认为至少有两种功能和形态相异的脂肪细胞。具体而言,白色脂肪细胞以单房大脂滴为特征,主要负责脂质储存;而棕色脂肪细胞则包含多个小脂滴,促进脂质利用和热量产生【4】。从功能上讲,细胞以单房脂滴储存脂质被推测可以通过降低脂滴的总表面积与体积比来减慢TG的降解【5-7】。然而现有传统脂解定量方法(如生化与同位素标记检测【8,9】)仅适用于细胞群水平检测,无法识别不同脂质存储形式的组织/细胞之间脂质储存和利用的异质性,也无法剖析脂解过程的时空动态差异,例如脂肪酸的脂解和再酯化过程【5,10】。另外,与在遗传学、发育生物学和癌症生物学等领域所开发出最先进的单细胞技术相比,代谢单细胞或单细胞器技术存在滞后发展的问题,特别是单细胞脂解新技术的开发与调控研究是一个亟待发展的领域。也因细胞异质性和技术限制,细胞脂解能力与脂滴形态之间的关系尚不清楚。
2025年8月8日,复旦大学代谢与整合生物学研究院陈丰荣研究员及其合作团队在Cell Reports期刊上在线发表了题为“Dissection of surface area-dependent lipolysis at a single organelle level”的研究论文。该团队基于成像技术开发出一种新型的脂肪细胞脂滴降解特性的检测方法,称为成像脂解法(Imaging Lipolysis assay),该方法能够在单颗脂滴分辨率下原位定量单一脂肪细胞的动态脂解通量(lipolytic flux)。研究发现脂滴的脂解通量是可变的,由脂滴上脂肪酶可及的脂滴表面积大小(生物物理)和脂解酶活性(等效脂解效率lipolytic efficiency,生物化学)两者共同决定。进一步研究发现,相比于负责脂质储存的白色脂肪细胞,产热型棕色脂肪细胞表现出更高的脂解通量与效率。此外,本研究还揭示了脂滴融合相关蛋白CLSTN3β/CIDE是通过增加脂滴总表面积与体积比的生物物理调节方式来促进脂肪降解,这与众所周知的脂肪酶活性的生化调节方式是不同的。

鉴于活细胞成像的发展,研究团队首先结合单细胞器的动态几何分析开发出Imaging Lipolysis方法,该检测方法包括四个步骤:细胞制备、活细胞成像、图像分析和生物物理计算(图1A)。以3T3-L1成熟脂肪细胞为模型,并用异丙肾上腺素处理15分钟来模拟生理性脂解;采用低光毒性明场延时活细胞成像追踪单细胞中所有可见的脂滴降解,并随机选择具有明显大小变化的脂滴进行后续的图像分析;如预期地,脂解刺激后会观察到脂滴体积逐渐减小,直至当前成像分辨率(~ 0.4 μm)无法分辨(图1B)。在第四步骤中,基于动态几何分析原理进行了生物物理计算,根据每颗脂滴的直径值计算其体积,随之计算每颗脂滴体积随时间的变化率,将其定义为一定时间间隔内脂滴的脂解通量(lipolytic flux,Ø)。通过脂滴脂解通量与其直径、表面积和体积之间的相关性分析后发现,脂滴脂解通量与脂滴的表面积呈线性关系(图1C)。这是第一个表明脂滴表面积决定脂解通量(生物物理调节)的关键实验证据。为此,将线性关系的导数定义为一个新的脂解指标,称为脂解效率(lipolytic efficiency,ĸ),并且此指标被证实等效于脂解酶活性(图1C)。
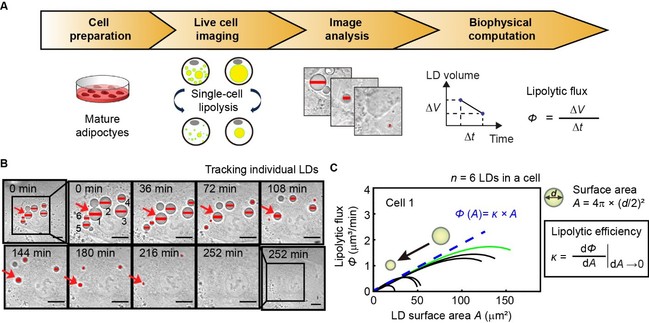
图1.(A)Imaging Lipolysis方法测量细胞内脂滴脂解通量的工作流程。(B)在明场观察下,记录脂解激活后细胞中脂滴降解的延时动态图像,红线表示随时间变化的脂滴直径(n = 6,用数字标记)。比例尺,10 µm;(放大)10 µm。(C)左图:六个脂滴脂解通量(Φ)与其表面积(A)的相关性分析。在(B)中,脂滴从同一个3T3-L1脂肪细胞中捕获。绿色曲线表示(B)中红色箭头标记脂滴的脂解通量。右上:脂滴表面积计算公式。右下:脂解效率κ的微分方程计算过程。
为了验证Imaging Lipolysis方法的有效性与准确性,研究团队通过调控脂肪细胞脂解酶活性、表达水平及敲低相关调节因子,并将其检测结果与传统生化方法进行比较。首先用不同浓度的异丙肾上腺素处理脂肪细胞,其脂解效率呈剂量依赖性增加(图2A),随后Imaging Lipolysis方法与生化测定结果(图2B)的比较表明,两种方法在定量脂解通量上具有高度一致性(相关系数R2 = 0.90)(图2C)。其次,对脂解限速酶PNPLA2及其负调节因子G0S2进行敲低,实验结果显示,与对照组相比,Pnpla2敲低脂肪细胞的脂解效率显著降低,而G0s2敲低细胞的脂解效率则提高了1.4倍(图2D)。同样与生化测定结果进行了比较(图2E),两种方法再次展现出高度的一致性(相关系数R2 = 0.99)(图2F)。综上,Imaging Lipolysis方法可定量评估异丙肾上腺素对脂解的剂量依赖性调节作用,以及PNPLA2和G0S2在细胞脂解过程中对脂肪的生化活性调节作用。
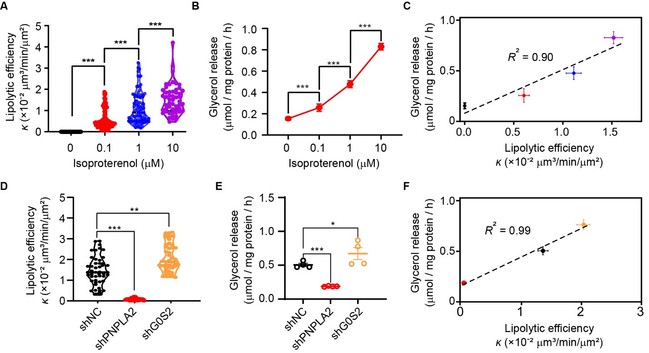
图2.(A)3T3-L1脂肪细胞经异丙肾上腺素(0、0.1、1和10 µM)处理后的脂解效率统计小提琴图。(B)3T3-L1脂肪细胞经异丙肾上腺素(0、0.1、1和10 µM)处理2小时后的甘油释放量。(C)甘油释放量在(B)与脂解效率在(A)的相关性分析图。(D)shNC、Pnpla2特异性shRNA(shPNPLA2)和G0s2特异性shRNA(shG0S2)脂肪细胞的脂解效率统计小提琴图。(E)shNC、shPNPLA2和shG0S2脂肪细胞的甘油释放量统计图。(F)甘油释放量在(E)与脂解效率在(D)的相关性分析图。
进一步地,研究团队解析了脂滴融合关键蛋白CLSTN3β/CIDE是如何促进脂解。利用Imaging Lipolysis方法对敲低Cidec的3T3-L1脂肪细胞的脂解性能进行检测(图3A),与对照组相比,Cidec敲低不会改变细胞的脂解效率(即脂解酶活性)(图3B),也不会改变PNPLA2蛋白表达量(图3A),但如预期地是可以增加单一细胞内总脂解通量,并缩短所有脂滴降解所需时间(图3C)。同样,在3T3-L1脂肪细中过表达CLSTN3β并使用Imaging Lipolysis方法检测(图3D)。与过表达GFP载体相比,CLSTN3β-GFP过表达不会改变细胞的脂解效率(图3E),但同样可以增加单一细胞内总脂解通量并缩短脂滴降解时间(图3F)。Cidec敲低与CLSTN3β过表达皆增加脂滴总表面积与体积比,表明CLSTN3β/CIDE是通过生物物理调节方式来促进脂解。此外,运用Imaging Lipolysis方法比较源自棕色脂肪组织(BAT)和皮下白色脂肪组织(sWAT)的原代基质血管细胞(SVF)分化而成的脂肪细胞的脂解特性,结果显示棕色脂肪细胞具有更高的脂解通量。进一步解析表明,这源于其更高的脂解效率(生物化学)与更高的脂滴表面积与体积比(生物物理)共同作用的结果。
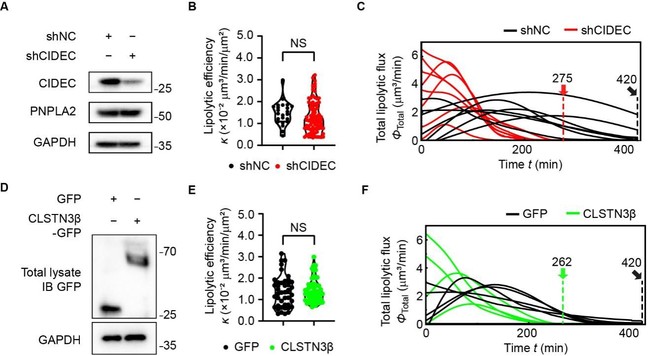
图3.(A)Western blot分析显示,在慢病毒Cidec特异性shRNA(shCIDEC)处理的3T3-L1脂肪细胞中,CIDEC蛋白表达显著减少,PNPLA2的表达无变化。GAPDH作为上样量对照。(B)shNC或shCIDEC脂肪细胞的脂解效率统计小提琴图。(C)曲线图显示shNC或shCIDEC脂肪细胞的总脂解通量动态变化图。(D)Western blot分析显示,3T3-L1脂肪细胞过表达GFP或CLSTN3β-GFP。GAPDH作为上样量对照。(E)过表达GFP(黑色)或CLSTN3β-GFP(绿色)脂肪细胞的脂解效率统计小提琴图。(F)曲线图显示了过表达GFP(黑色)或CLSTN3β-GFP(绿色)脂肪细胞的总脂解通量动态变化图。
综上,这项研究建立的Imaging Lipolysis方法可以在单细胞解析水平下直接定量测量脂解通量和脂解酶活性相关的降解效率,并首次揭示脂解过程受生物化学(酶活性)和生物物理学(脂滴形态)的双重机制调控(图4)。除了普遍的脂解定量外,该方法也特别适用于解析具有高度异质性、罕见性、基因编辑困难或脂肪酸再酯化活跃等特征的细胞模型中的脂解动态调控机制。凭借其单细胞解析能力,Imaging Lipolysis方法有望成为未来深入探究脂解代谢等复杂生物学问题的开创性工具。
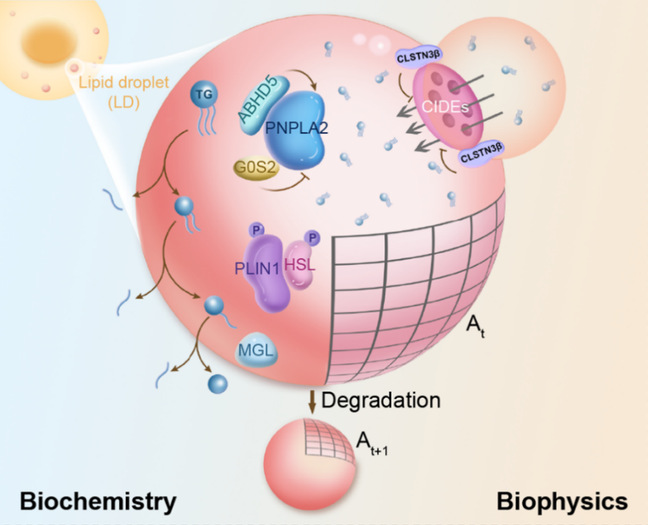
图4. Imaging Lipolysis方法揭示脂滴降解的生化与生物物理双重调控
复旦大学代谢与整合生物学研究院马成新博士生为该论文的第一作者,复旦大学代谢与整合生物学研究院陈丰荣研究员和郑州大学李蓬院士为共同通讯作者,清华大学徐俐副研究员,德克萨斯大学休斯敦健康科学中心杨洪远教授与复旦大学代谢与整合生物学研究院赵同金教授为本研究提供了重要帮助和支持。
原文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(25)00871-X
参考文献:
Walther, T. C., Chung, J., and Jr., R. V. F. (2017) Lipid Droplet Biogenesis. Annu. Rev. Cell Dev. Biol. 33, 491-510.https://doi.org/10.1146/annurev-cellbio-100616-060608
Olzmann, J. A., and Carvalho, P. (2019) Dynamics and functions of lipid droplets. Nat. Rev. Mol. Cell Bio. 20, 137-155. https://doi.org/10.1038/s41580-018-0085-z
Grabner, G. F., Xie, H., Schweiger, M., and Zechner, R. (2021) Lipolysis: cellular mechanisms for lipid mobilization from fat stores. Nat. Metab. 3, 1445-1465. https://doi.org/10.1038/s42255-021-00493-6
Sakers, A., De Siqueira, M. K., Seale, P., and Villanueva, C. J. (2022) Adipose-tissue plasticity in health and disease. Cell 185, 419-446. https://doi.org/10.1016/j.cell.2021.12.016
Rambold, A.S., Cohen, S., and Lippincott-Schwartz, J. (2015) Fatty acid trafficking in starved cells: Regulation by lipid droplet lipolysis, autophagy, and mitochondrial fusion dynamics. Dev. Cell 32, 678-692. https://doi.org/10.1016/j.devcel.2015.01.029
Nishimoto, Y. and Tamori, Y. (2017) CIDE family-mediated unique lipid droplet morphology in white adipose tissue and brown adipose tissue determines the adipocyte energy metabolism. J. Atheroscler. Thromb. 24, 989-998. https://doi.org/10.5551/jat.RV17011
Chen, F. J., Yin, Y., Chua, B. T., and Li, P. (2020) CIDE family proteins control lipid homeostasis and the development of metabolic diseases. Traffic 21, 94-105. https://doi.org/10.1111/tra.12717
Zimmermann, R. et al. (2004) Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase. Science 306, 1383-1386. https://doi.org/10.1126/science.1100747
Lass, A. et al. (2006) Adipose triglyceride lipase-mediated lipolysis of cellular fat stores is activated by CGI-58 and defective in Chanarin-Dorfman Syndrome. Cell Metab. 3, 309-319.
Nguyen, T. B. et al. (2017). DGAT1-dependent lipid droplet biogenesis protects mitochondrial function during starvation-induced autophagy. Dev. Cell 42, 9-21. https://doi.org/10.1016/j.devcel.2017.06.003




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台