
代谢失调是癌症的典型特征。癌细胞通过代谢重塑维持生物合成,以在氧气和营养匮乏的肿瘤微环境中存活,并逃避免疫监视或药物治疗[1,2]。在癌细胞适应代谢应激时,丝氨酸/苏氨酸激酶(AMPK)作为能量感应器,其激活后可抑制脂质和蛋白质合成,同时促进葡萄糖摄取、脂肪酸氧化(FAO)、线粒体与溶酶体生物合成,共同维持能量和氧化还原稳态[3,4]。遗传学研究表明,敲除AMPK编码基因可显著抑制多种体内肿瘤进展[5,6],提示阻止AMPK激活可能削弱癌细胞的能量感知能力和代谢适应性,进而阻止肿瘤进展,但目前缺乏相关的干预策略。值得注意的是,AMPK除了磷酸化和泛素化水平的调控外,蛋白水平的其他调控机理尚不清楚。另一方面,α-酮戊二酸(α-KG)作为三羧酸(TCA)循环中间代谢物、双加氧酶辅因子及信号分子[7-9],是否以及如何调控癌细胞的代谢适应性尚不明确。
2025年8月22日,复旦大学代谢与整合生物学研究院李福明课题组在国际知名期刊Nature Chemical Biology上发表了题为“α-Ketoglutarate dictates AMPK protein synthesis for energy sensing in human cancers”的论文。该研究发现代谢物α-酮戊二酸(α-KG)通过TET-YBX1轴控制AMPK蛋白合成,进而调节人类特异的癌细胞能量感知能力并抵抗双硫死亡(Disulfidptosis)。机制上,α-KG匮乏抑制DNA去甲基化酶TET活性,降低RNA结合蛋白YBX1的转录——该蛋白结合人PRKAA1 特异的5’UTR 控制着AMPKa1(AMPK催化亚基)蛋白合成。因此,α-KG匮乏使得癌细胞无法激活AMPK,导致能量应激下胞质NADPH水平显著下降并最终引发双硫死亡。此外,包括琥珀酸和衣康酸在内的α-KG竞争性结构类似物也能抑制YBX1-AMPK轴,增强癌细胞对能量应激的敏感性(图1)。
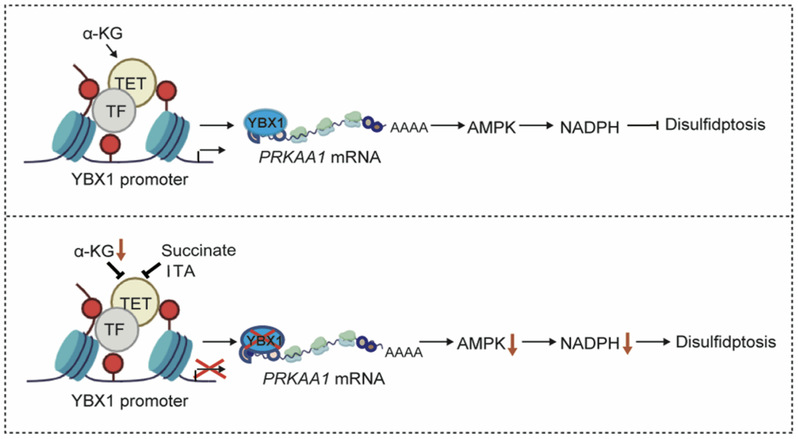
图1:α-酮戊二酸调控AMPK蛋白合成及能量感知的工作模式图。
首先,研究人员发现GDH1-α-KG代谢轴失活显著降低胞内α-KG水平并使得癌细胞对葡萄糖饥饿敏感,而外源添加α-KG可阻止这一过程(图2A)。免疫荧光染色和非还原性蛋白印迹结果显示,葡萄糖饥饿时,α-KG匮乏的癌细胞中细胞骨架蛋白发生二硫键交联和细胞骨架重塑,这种表型可被还原剂TCEP预处理挽救(图2B、C), 提示细胞发生了双硫死亡。双硫死亡主要由细胞内NADPH减少引起的二硫键交联和细胞骨架重塑所致[10]。研究人员采用基因编码的荧光传感器iNap1监测胞质NADPH水平,发现α-KG匮乏确实降低了胞质而非线粒体NADPH水平(图2D)。
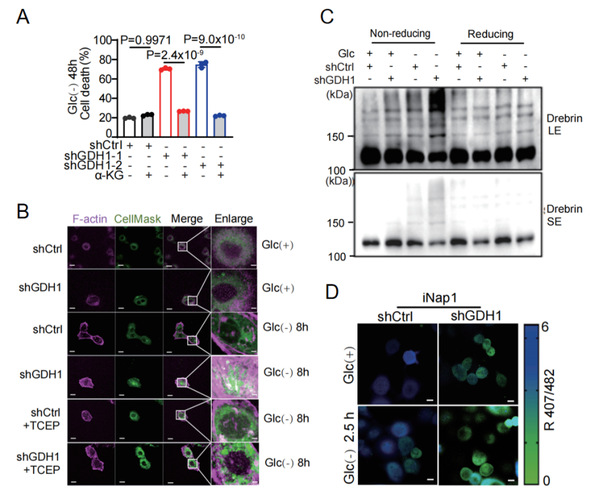
图2:α-酮戊二酸匮乏诱导癌细胞发生双硫死亡。
(A)在葡萄糖饥饿的情况下,对照组( shCtrl )、GDH1敲降组( shGDH1 )和敲降后外源补充组( shGDH1+α-KG )细胞的死亡率。(B)对照组(shCtrl)和敲降组(shGDH1)的细胞中F-肌动蛋白 (F-actin) 和细胞膜 (Cell Mask)的免疫荧光染色。比例尺:10 µm。(C)对照组( shCtrl )和GDH1敲降组( shGDH1 )进行非还原和还原处理后Drebrin的免疫印迹结果。(D)对照组(shCtrl)和敲降组(shGDH1)的 H1299细胞在葡萄糖饥饿2.5 h时的iNap1代表性荧光图。比例尺:10 µm。
AMPK在葡萄糖饥饿时促进脂肪酸氧化和线粒体生物合成以维持NADPH稳态[11]。研究人员发现α-KG降低了AMPK a1的蛋白合成,导致胞质NADPH耗竭。进一步结合基因敲降、荧光素酶报告基因分析和RNA免疫沉淀(RIP)等实验手段筛选出RNA结合蛋白YBX1介导了α-KG对AMPK的翻译调节:一方面,YBX1结合到PRKAA1 5’UTR上特异性调控人AMPK a1蛋白翻译(图3A-D);另一方面,α-KG匮乏通过抑制TET活性降低YBX1启动子区域DNA去甲基化,进而抑制YBX1转录,最终减少AMPK a1蛋白合成(图3E、F)。值得一提的是,只有人PRKAA1 mRNA才具有这一段5’UTR,且小鼠细胞的体内外数据表明,GDH1-YBX1信号轴并不控制AMPK蛋白合成,提示α-KG对AMPK的翻译调节具有物种特异性。
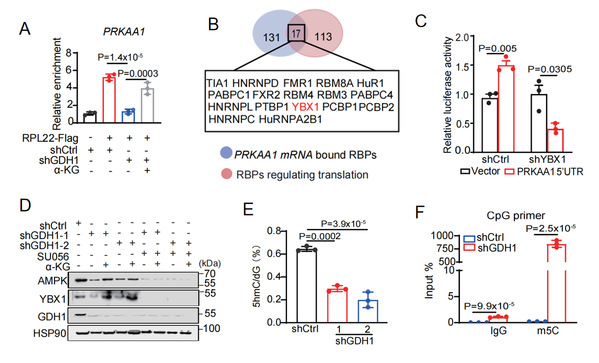
图3:α-KG维持TET依赖的 YBX1 转录进而调控AMPK翻译。
(A)RIP-q-PCR分析各组PRKAA1 mRNA水平,相对富集度通过将数值与对照组进行归一化处理。(B)筛选AMPK翻译调节因子。蓝色表示与PRKAA1 mRNA结合的RBP,红色表示调控翻译的RBP。(C)shCtrl和shYBX1 细胞中相对荧光素酶活性。(D)对照(Veh)或YBX1抑制剂SU056 (1µM)处理的细胞中AMPK和YBX1的免疫印迹分析。HSP90作为上样对照。(E)LC-MS分析对shCtrl和shGDH1细胞中相对5hmC丰度进行定量。(F)使用YBX1 CpG岛特异性引物对shCtrl和shGDH1的细胞进行MeDIP-qPCR分析。
基于上述结果,研究人员设想,抑制癌细胞摄取葡萄糖时会诱导能量应激,此时阻止AMPK蛋白合成将使得细胞无法感知能量危机,进而可能诱发双硫死亡。结果证实,同时敲低葡萄糖转运体GLUT1和YBX1以“合成致死“的方式诱导癌细胞死亡。体内实验进一步证实,采用GLUT1和YBX1的小分子抑制剂联合用药可显著抑制肺癌患者来源的异种移植瘤(PDX)生长,并显著降低AMPK蛋白水平(图4A、B)。由于GLUT1和YBX1在肿瘤中呈现高表达,与病人预后呈负相关性,该结果提示GLUT1和YBX1可作为生物标志物和潜在联合用药抗癌靶点。
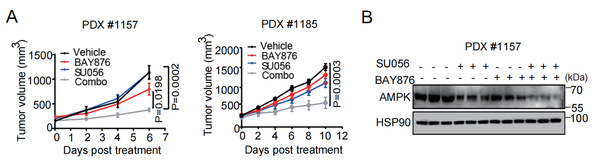
图4:BAY-876/SU056体内联用抑制肿瘤生长。
(A)肺癌PDX模型生长曲线图,包含对照组及指定单药或联合治疗组。(B)PDX#1157肿瘤组织中AMPK的免疫印迹分析结果。
综上所述,本研究首次将代谢物α-KG与癌细胞能量和细胞死亡建立了联系:α-KG通过维持能量传感器AMPK的蛋白质合成,在细胞能量感知和抵抗双硫死亡中发挥关键作用,且这一功能具有人类特异性。该研究提示,阻断YBX1依赖的AMPK翻译,在GLUT1抑制引发的能量应激状态下,这种靶向细胞能量感知的手段可能成为潜在的癌症干预策略。
复旦大学代谢与整合生物学研究院李福明青年研究员为本文通讯作者,复旦大学代谢与整合生物学研究院米雯博士、国科大杭州高等研究院-分子细胞科学卓越创新中心薛云博士(季红斌课题组)为本文共同第一作者。该研究受到科技部重点研发计划和国家自然科学基金委面上项目支持,同时得到了 复旦大学人类表型组研究院刘苹羽课题组,复旦大学基础医学院李飞课题组,复旦大学代谢与整合生物学研究院任若冰课题组、王冠琳课题组、陈立课题组、许毅课题组、毕俊峰课题组,复旦大学生物医学研究院叶丹课题组和中国科学院分子细胞卓越科学创新中心/西湖大学季红斌课题组的大力支持。
原文链接:https://www.nature.com/articles/s41589-025-02013-z
参考文献:
Pavlova, N.N. & Thompson, C.B. The Emerging Hallmarks of Cancer Metabolism. Cell Metab 23, 27-47 (2016).
Faubert, B., Solmonson, A. & DeBerardinis, R.J. Metabolic reprogramming and cancer progression. Science 368 (2020).
Jager, S., Handschin, C., St-Pierre, J. & Spiegelman, B.M. AMP-activated protein kinase (AMPK) action in skeletal muscle via direct phosphorylation of PGC-1alpha. Proc Natl Acad Sci U S A 104, 12017-12022 (2007).
Steinberg, G.R. & Hardie, D.G. New insights into activation and function of the AMPK. Nat Rev Mol Cell Biol 24, 255-272 (2023).
Eichner, L.J. et al. Genetic Analysis Reveals AMPK Is Required to Support Tumor Growth in Murine Kras-Dependent Lung Cancer Models. Cell Metab 29, 285-302 e287 (2019).
Chan, L.N. et al. Metabolic gatekeeper function of B-lymphoid transcription factors. Nature 542, 479-483 (2017).
Yang, C. et al. Glutamine oxidation maintains the TCA cycle and cell survival during impaired mitochondrial pyruvate transport. Mol Cell 56, 414-424 (2014).
Morris, J.P.t. et al. alpha-Ketoglutarate links p53 to cell fate during tumour suppression. Nature 573, 595-599 (2019).
Jin, L. et al. The PLAG1-GDH1 Axis Promotes Anoikis Resistance and Tumor Metastasis through CamKK2-AMPK Signaling in LKB1-Deficient Lung Cancer. Mol Cell 69, 87-99 e87 (2018).
Liu, X. et al. Actin cytoskeleton vulnerability to disulfide stress mediates disulfidptosis. Nat Cell Biol 25, 404–414 (2023).
Jeon, S.M., Chandel, N.S. & Hay, N. AMPK regulates NADPH homeostasis to promote tumour cell survival during energy stress. Nature485, 661-665 (2012).




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台