
氨基酸是一种优质的营养来源。然而,氨基酸氧化产生的氨具有很强的神经毒性。血液中氨水平的异常升高会引起高氨血症(hyperammonemia,又称尿素循环代谢病),最终造成中枢神经系统功能障碍,例如脑水肿和脑疝。肝癌病人由于肝脏氨排毒功能障碍经常导致高血氨症,直接威胁病人生命。因此,阐明肝脏的氨脱毒机制具有重要的理论与临床转化价值。
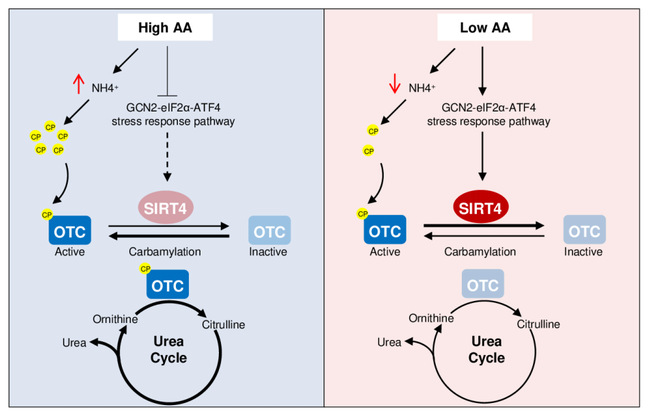
氨基酸的氧化脱氨在具有双层膜包裹的线粒体内进行,以防止氨泄露到细胞质及其它亚细胞器,降低氨对细胞的毒性。肝脏的线粒体中高表达一种叫氨甲酰磷酸合成酶1(carbamoyl phosphate synthetase I,CPS1)的催化酶, 将氨基酸氧化脱下的氨迅速转化为毒性较低的氨甲酰磷酸(carbamoyl phosphate,CP)。接下来,CP会通过鸟胺酸氨甲酰基转移酶(Ornithine Transcarbamylase,OTC)进入尿素循环(the Urea Cycle)生成尿素将氨排出体外。同时,CP也是核苷酸从头合成的原料,参与细胞周期和细胞分裂过程。CP具有很强的反应活性,自发与赖氨酸的末端氨基(氨基)反应生成赖氨酸氨甲酰修饰(lysine carbamylation,CP-K)。CP-K也许是自然界中最为重要的一种蛋白质翻译后修饰,因为光合作用依赖的羧化酶(ribulose-1,5-bisphosphate carboxylase–oxygenase,RuBisCO)依赖于CP-K的激活1。尽管如此,CP-K在哺乳动物中的功能却依然知之甚少。
2023年4月20日,复旦大学赵世民/徐薇/赵健元合作团队在Nature Metabolism杂志上发表了题为Amino acids downregulate SIRT4 to detoxify ammonia through the urea cycle的研究成果,揭示了SIRT4调控细胞氨脱毒机制。

该研究发现,CP不仅仅是作为OTC的底物,还会直接修饰到OTC 催化活性中心附近的307位赖氨酸上促进OTC的酶活。这说明当氨基酸的分解代谢旺盛时,CP会通过变构激活的方式来促进氨的清除。而定位于线粒体的Sirtuin蛋白——SIRT4则会以NAD+依赖的方式去除OTC上CP-K修饰,并且SIRT4的表达会受到细胞内氨基酸水平的调控。这说明SIRT4会响应细胞内氨基酸水平的变化并通过调节OTC上的CP-K修饰来调控细胞内氨的代谢去路。在四氯化碳诱导的肝性脑病(由高氨血症所引起的一种并发症)小鼠模型中,敲除SIRT4可以降低小鼠的血氨浓度,改善肝性脑病的各项病理指标,提示SIRT4可能会作为肝性脑病的一个新的干预靶点。
该工作由复旦大学赵世民、徐薇、赵健元团队完成,清华大学李海涛团队提供了关键的技术帮助。复旦大学附属红房子妇产科医院/遗传工程国家重点实验室/代谢与整合生物学研究院/生物医学研究院博士生胡颂华(已毕业)、冯雨阳为论文共同第一作者。
论文链接:
https://www.nature.com/articles/s42255-023-00784-0
参考文献:
Stec, B. Structural mechanism of RuBisCO activation by carbamylation of the active site lysine. P Natl Acad Sci USA 109, 18785-18790, doi:10.1073/pnas.1210754109 (2012).




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台