
小G蛋白Arf1已被确定在支持癌症干细胞(CSC)方面发挥选择性作用,使其成为癌症治疗的一个有吸引力的靶点。然而,目前的Arf1抑制剂由于毒性高、特异性低,转化潜力有限。
2024年9月3日,复旦大学生命科学学院/代谢与整合生物学研究院侯宪玉及其合作团队在Advanced Science在线发表题为“Novel Arf1 Inhibitors Drive Cancer Stem Cell Aging and Potentiate Anti-Tumor Immunity”的研究论文。该研究中,介绍了两种用于癌症治疗的新型强效Arf1小分子抑制剂,即DU101和DU102。
临床前肿瘤模型表明,这些抑制剂引发了CSC中的衰老级联,并增强了小鼠癌症和PDX模型中的抗肿瘤免疫力。通过单细胞测序,分析了这些新型Arf1抑制剂诱导的肿瘤免疫微环境重塑,并确定了肿瘤相关CD8+CD4+双阳性T(DPT)细胞的增加。这些DPT细胞表现出活性CD8单阳性T细胞的优越特征和更高百分比的TCF1+PD-1+,这是干细胞样T细胞的特征。肿瘤浸润干细胞样DPT细胞的频率与癌症患者更好的无病生存期(DFS)相关,表明这些抑制剂可以通过将冷肿瘤免疫微环境转变为热免疫微环境来提供一种新的癌症免疫治疗策略,从而扩大癌症患者免疫治疗的潜力。

小G蛋白Arf1是ADP-核糖基化因子(Arf)小G蛋白家族的成员,位于多个细胞器的界面。其作用包括协调细胞器通讯、脂肪酸代谢和维持线粒体稳态。研究表明,Arf1在各种类型的人类癌症中表达量较高,包括但不限于乳腺癌、肝细胞癌、结肠癌和前列腺癌。并且,Arf1表达升高与被诊断患有癌症的个体的预后呈负相关。
作者最近的研究表明,Arf1调节的脂质代谢在选择性维持癌症干细胞和神经元的稳态方面起着至关重要的作用。在果蝇中,肠道和马氏管(肾脏)分化细胞中Arf1的敲除不会产生可辨别的表型。然而,干细胞中Arf1的敲除会引发细胞器老化的级联反应(表现出衰老的特征),包括脂滴(LD)积聚、线粒体损伤、活性氧(ROS)产生、内质网(ER)应激和溶酶体蛋白聚集。果蝇体内的异常干细胞通过传递危险信号激活邻近的肠细胞(EC),导致受损干细胞通过杀伤、吞噬和清除过程被清除。
在小鼠中,敲除肝细胞中含有白蛋白-Cre(Alb-Cre)的Arf1或敲除正常成人肠道干细胞中含有Lgr5-CreER的Arf1不会产生任何表型,而敲除肠道中含有Lgr5-CreER的癌症干细胞(CSC)或肝脏中含有Axin2-CreER的癌症干细胞(CSC)中的Arf1则会引发类似的细胞器衰老级联反应。异常的CSC随后会发出危险信号,激活肿瘤免疫微环境中的抗原呈递树突状细胞(DC)。与目前的治疗方法相比,Arf1靶向疗法通过促进CSC衰老和增强免疫细胞的抗肿瘤活性提供了双重抗癌机制。然而,还需要进一步研究以了解Arf1靶向疗法调节的抗肿瘤免疫反应。
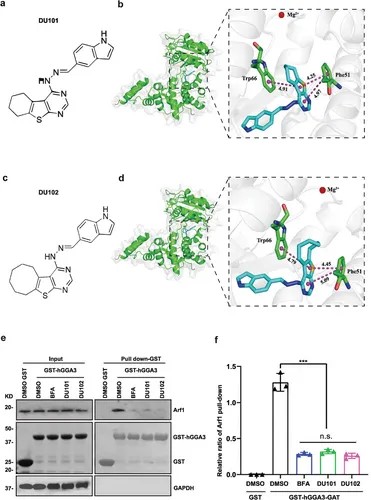
DU101和DU102是Arf1的新型强效抑制剂。(图源自Advanced Science)
现有的Arf1抑制剂(如Golgicide A (GCA)、Brefeldin A (BFA) 和 Exo2)毒性大、特异性低,极大地限制了它们的转化潜力和相关研究。模型生物中的遗传筛选已广泛用于研究基因的生物学功能。迄今为止,此类筛选在识别与肿瘤免疫相关的靶基因方面的应用有限。作者之前的研究表明,在COPI/Arf1-脂解途径被敲低后,果蝇马氏小管(MT,苍蝇肾脏)中的RasV12转化干细胞肿瘤可通过坏死选择性根除。该过程保留了分化细胞。值得注意的是,将现有的Arf1抑制剂施用于苍蝇可导致致瘤干细胞的靶向消除,同时不会伤害正常干细胞。
在这里,在果蝇干细胞肿瘤系统中,基于Exo2改良的100多种化学物质的筛选,发现了两种用于癌症治疗的新型强效Arf1小分子抑制剂,分别称为DU101和DU102。实验表明,这些新设计的Arf1抑制剂在各种小鼠肿瘤模型(包括肝、结肠、乳腺和黑色素瘤)以及PDX肿瘤模型中表现出低毒性和强大的抗肿瘤活性。用抑制剂治疗显著增强了T细胞肿瘤浸润,增强了CD8+ T细胞通过ATP的活化。因此,新的Arf1抑制剂为癌症免疫治疗提供了一种有利的策略,目前正在对晚期实体瘤患者进行临床试验评估。
原文链接:
https://doi.org/10.1002/advs.202404442




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台