
肝再生障碍是肝脏手术或损伤后常见的并发症,可能导致术后肝功能不全甚至肝衰竭,严重危及患者生命。慢性脂肪肝患者肝脏脂质积累过多,代谢灵活性下降,肝细胞增殖受限,从而显著降低肝再生能力。肝脏再生需要大规模的代谢重塑,其中最显著的特征是早期瞬时的甘油三酯(TG)在脂滴中积累。然而,这一过程高度动态,其快速峰值与消退提示存在精细调控机制,尤其是脂滴中脂质的动员可能比储存更为关键。一个长期未解之谜是:脂滴相关蛋白如何在其中发挥调控作用?
2025年11月19日,复旦大学代谢与整合生物学研究院杨天舒青年研究员及其合作团队在Advanced Science期刊发表了题为“CIDEC Restricts Liver Regeneration by Disturbing Lipid Droplet Triglyceride Turnover”的最新研究成果。该研究首次揭示,肝再生依赖于TG储存与利用的平衡,脂滴相关蛋白CIDEC作为关键代谢开关,通过调控TG合成与分解影响肝脏再生,其下调可以恢复慢性脂肪肝中受损的肝再生能力,促进脂质动员和脂肪酸氧化,为肝脏再生提供能量支持。

研究团队通过对小鼠部分肝切除(PHx)过程中肝脏组织进行脂质组学与转录组学分析发现,肝再生早期肝脏发生显著脂质重塑,TG与甘油二酯瞬时升高。同时,对代谢相关基因进行聚类分析发现,肝再生早期上调显著的基因涉及TG代谢、脂滴组织、脂肪酸β-氧化及脂质储存,提示肝脏在储存脂质的同时也积极进行TG分解,其中脂滴融合相关基因Cidec的上调最为显著,其表达峰值与肝内TG积累同步,并受肝特异转录因子转录因子CREBH调控。
为探讨CIDEC是否参与调节肝脏再生,研究人员利用AAV载体在小鼠肝脏中敲低CIDEC(shCIDEC),发现CIDEC缺失导致肝脏再生显著加速。这一促进作用在机械损伤(PHx)和化学损伤(CCl₄)模型中均成立。相反,在小鼠肝细胞中特异性过表达CIDEC则显著抑制肝再生,提示CIDEC在肝再生过程中起负向调控作用。
为进一步探究CIDEC对肝再生的调控机制,研究人员在shCIDEC和CIDEC过表达小鼠中,于PHx不同时间点分离原代肝细胞,结果显示,12–36小时内shCIDEC肝细胞脂滴显著缩小,而CIDEC过表达则增加脂滴体积。对照和shCIDEC小鼠在PHx后肝内TG同时达峰值,但shCIDEC小鼠肝内TG下降更快。体外实验显示,shCIDEC原代肝细胞脂解及脂肪酸β-氧化(FAO)显著增强,提示TG储存被更有效动员和利用。在对照及shCIDEC小鼠中,使用FAO抑制剂阻断脂肪酸进入线粒体后,CIDEC缺失带来的肝再生优势被消除,表明增强FAO是CIDEC缺失促进肝再生的关键机制。
为进一步验证TG合成及分解平衡在肝脏再生中的作用,研究人员通过在小鼠肝细胞特异性过表达TG合成酶DGAT2,发现直接增强TG合成导致脂滴峰值后TG滞留,脂质动员受阻,从而显著抑制肝再生。这表明过度的TG合成和储存会阻碍脂质动员,限制肝细胞增殖。
值得注意的是,在高脂饮食诱导的慢性脂肪肝小鼠中,CIDEC表达升高并伴随肝再生受损。特异性敲低CIDEC能够显著改善HFD小鼠的肝再生能力,使多项增殖指标恢复到正常饮食小鼠的水平。同时,虽然shCIDEC-高脂喂养小鼠与对照高脂喂养小鼠相比,肝脏总TG含量变化不大,但脂滴体积显著减小,同时血清中FAO代谢产物血清3-羟基丁酸显著升高,表明shCIDEC-高脂喂养小鼠肝脏中FAO显著增强。
综上所述,这一发现揭示了脂滴融合相关蛋白CIDEC是调控肝脏TG储存与利用平衡的关键代谢检查点,其下调可增强代谢灵活性、促进脂质动员并改善肝再生能力。靶向CIDEC的药物或营养干预,有望成为慢性脂肪肝相关肝再生障碍的潜在治疗策略。
复旦大学代谢与整合生物学研究院欧阳峰博士生、李怡宁硕士生、张子萱博士生为该论文的共同第一作者,复旦大学代谢与整合生物学研究院杨天舒青年研究员和郑州大学李蓬院士为共同通讯作者。复旦大学代谢与整合生物学研究院赵同金教授为本研究提供了重要帮助和支持。
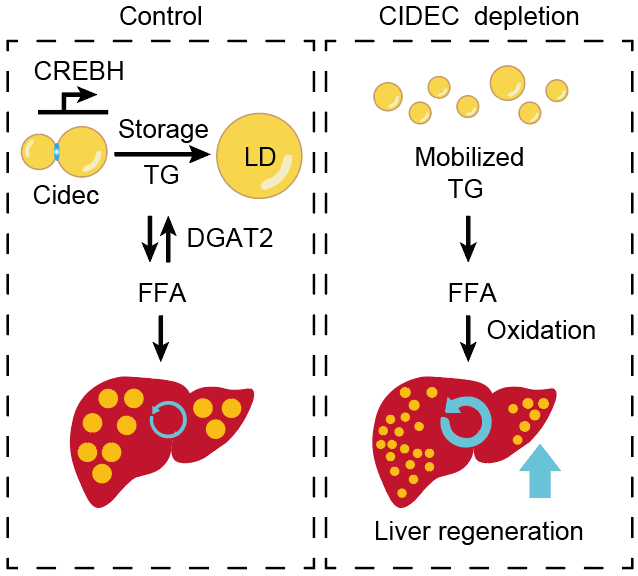
图:CIDEC通过干扰脂滴中甘油三酯周转抑制肝脏再生
原文链接:
https://doi.org/10.1002/advs.202507048




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台