
脂肪酸是一组疏水分子,在细胞活动中发挥多种作用,包括生物膜合成、能量储存、燃料、生物活性脂质前体、信号分子和脂质修饰底物等1-3。为了满足细胞的特定需要,细胞在不同的生理或病理条件下表现出对脂肪酸不同程度的吸收,协调维持机体代谢稳态。脂肪酸摄取失调可导致肥胖、脂肪肝、心力衰竭和癌症进展等疾病4-7。深入了解不同细胞在特定条件下的脂肪酸吸收机制,对于深入了解脂肪酸吸收异常引发的疾病意义重大。
赵同金课题组聚焦脂肪酸吸收和储存的调控机制研究,旨在阐明其调控异常导致肥胖和脂肪肝等代谢性疾病发生发展的原因。课题组以在脂肪酸吸收中发挥重要作用的CD36蛋白为研究对象,发现CD36在白色脂肪细胞和肌肉干细胞中的调控方式不同。在白色脂肪细胞中,CD36通常位于细胞表面,其脂肪酸吸收活性受到动态棕榈酰化调控:棕榈酰化修饰对于CD36的质膜定位是必须的8,而去棕榈酰化能够让CD36以内吞的方式促进脂肪酸吸收9。在肌肉干细胞中,CD36主要位于细胞内囊泡上,肌肉损伤后在生长因子IGF1刺激下转移到细胞表明进行脂肪酸吸收,促进肌肉干细胞增殖和肌肉损伤修复10。这些研究表明,为适应不同组织细胞的功能需求,CD36在不同组织细胞中的调控方式不同。
2024年10月26日,复旦大学代谢与整合生物学研究院赵同金课题组受邀在Trends in Endocrinology & Metabolism发表综述文章(Feature review)Context-specific fatty acid uptake is a finely-tuned multi-level effort,对不同细胞在特定条件下的特异性脂肪酸吸收机制以及相关的疾病进行了全面的总结。

文章系统阐述了不同的细胞类型如何根据其生理或病理条件特异地吸收脂肪酸。作者称这种现象为context-specific fatty acid uptake(组织细胞特异性的脂肪酸吸收)(图1)。作者总结了脂肪细胞、骨骼肌细胞、肌肉细胞、心肌细胞、肌肉干细胞、肝细胞、内皮细胞、各种癌细胞等多种细胞的脂肪酸吸收机制。并探讨了不同条件下,这些组织如何互相协同作用共同影响脂肪酸代谢稳态和机体生命活动。此外,作者还探讨了上述细胞脂肪酸吸收异常会引起的各类疾病,CD36作为脂肪酸吸收的重要蛋白,靶向该受体可能为脂肪肝、心力衰竭、许多类型的癌症和其他相关疾病提供潜在的治疗策略。文章最后指出了组织细胞特异性的脂肪酸吸收目前还没解决的关键问题,解决这些问题能让我们更好地了解组织之间如何协同作用来维持机体脂肪酸代谢稳态。
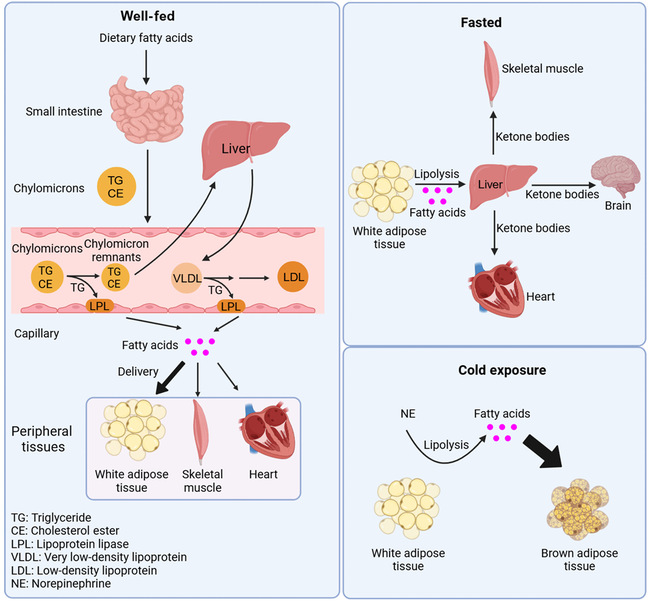
图1 组织细胞特异性的脂肪酸吸收
复旦大学代谢与整合生物学研究院青年副研究员王娟,厦门大学生命科学学院副教授郭慧玲和复旦大学代谢与整合生物学研究院博士生郑浪帆为该论文的共同第一作者,复旦大学代谢与整合生物学研究院赵同金教授、郑州大学李蓬教授为本论文的共同通讯作者。
原文链接:
https://www.sciencedirect.com/science/article/abs/pii/S104327602400256X
参考文献:
1.Su, X., and Abumrad, N.A. (2009). Cellular fatty acid uptake: a pathway under construction. Trends Endocrinol Metab 20, 72-77. 10.1016/j.tem.2008.11.001.
2.Pepino, M.Y., Kuda, O., Samovski, D., and Abumrad, N.A. (2014). Structure-function of CD36 and importance of fatty acid signal transduction in fat metabolism. Annu Rev Nutr 34, 281-303. 10.1146/annurev-nutr-071812-161220.
3.Samovski, D., Jacome-Sosa, M., and Abumrad, N.A. (2023). Fatty Acid Transport and Signaling: Mechanisms and Physiological Implications. Annu Rev Physiol 85, 317-337. 10.1146/annurev-physiol-032122-030352.
4.Mann, J.P., and Savage, D.B. (2019). What lipodystrophies teach us about the metabolic syndrome. J Clin Invest 129, 4009-4021. 10.1172/JCI129190.
5.Polyzos, S.A., Vachliotis, I.D., and Mantzoros, C.S. (2023). Sarcopenia, sarcopenic obesity and nonalcoholic fatty liver disease. Metabolism 147, 155676. 10.1016/j.metabol.2023.155676.
6.Glatz, J.F.C., Heather, L.C., and Luiken, J. (2024). CD36 as a gatekeeper of myocardial lipid metabolism and therapeutic target for metabolic disease. Physiol Rev 104, 727-764. 10.1152/physrev.00011.2023.
7.Harayama, T., and Riezman, H. (2018). Understanding the diversity of membrane lipid composition. Nat Rev Mol Cell Biol 19, 281-296. 10.1038/nrm.2017.138.
8.Wang, J., Hao, J.W., Wang, X., Guo, H., Sun, H.H., Lai, X.Y., Liu, L.Y., Zhu, M., Wang, H.Y., Li, Y.F., et al. (2019). DHHC4 and DHHC5 Facilitate Fatty Acid Uptake by Palmitoylating and Targeting CD36 to the Plasma Membrane. Cell Rep 26, 209-221 e205. 10.1016/j.celrep.2018.12.022.
9.Hao, J.W., Wang, J., Guo, H., Zhao, Y.Y., Sun, H.H., Li, Y.F., Lai, X.Y., Zhao, N., Wang, X., Xie, C., et al. (2020). CD36 facilitates fatty acid uptake by dynamic palmitoylation-regulated endocytosis. Nat Commun 11, 4765. 10.1038/s41467-020-18565-8.
10.Wang, J., Li, D.L., Zheng, L.F., Ren, S., Huang, Z.Q., Tao, Y., Liu, Z., Shang, Y., Pang, D., Guo, H., et al. (2024). Dynamic palmitoylation of STX11 controls injury-induced fatty acid uptake to promote muscle regeneration. Dev Cell 59, 384-399 e385. 10.1016/j.devcel.2023.12.005.




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台