
急性髓系白血病(AML)是一种因造血干细胞异常增殖导致的恶性血液疾病,其治疗面临白血病干细胞所致的高复发率和化疗耐药挑战,患者五年存活率不足30%。当前基于细胞表面标记物的识别方法因高度异质性而应用受限。研究表明,细胞代谢状态能动态反映白血病细胞的异质性,而线粒体作为细胞能量与代谢中枢,其功能与细胞命运紧密相关。在AML中,线粒体蛋白高表达提示不良预后,但如何有效靶向线粒体进行治疗仍是难题。
2025年11月25日,复旦大学代谢与整合生物学研究院叶浩彬课题组在Cell Reports上发表题为“A generalized strategy to kill leukemic cells by targeting the regulatory systems governing mitochondrial membrane potential”的研究论文。该研究报道了靶向降低线粒体膜电位(MMP)可有效杀伤白血病干细胞;筛选并鉴定出小分子药物阿来西定(Alexidine, AD)具有显著抗白血病活性,并阐明了其通过心磷脂介导的作用机制;揭示了内源性代谢物天冬酰胺(Asparagine)在白血病细胞自主调节MMP中的关键作用。

研究发现,MMP升高是白血病细胞发生转化和产生化疗耐药的重要标志。基于此,研究人员筛选出能够降低MMP的药物AD。在体外实验和多种白血病小鼠模型中,AD均表现出强大的抗白血病效果,并能显著增强化疗药物阿糖胞苷(Ara-C)的敏感性。
作用机制一:AD通过结合心磷脂抑制线粒体功能
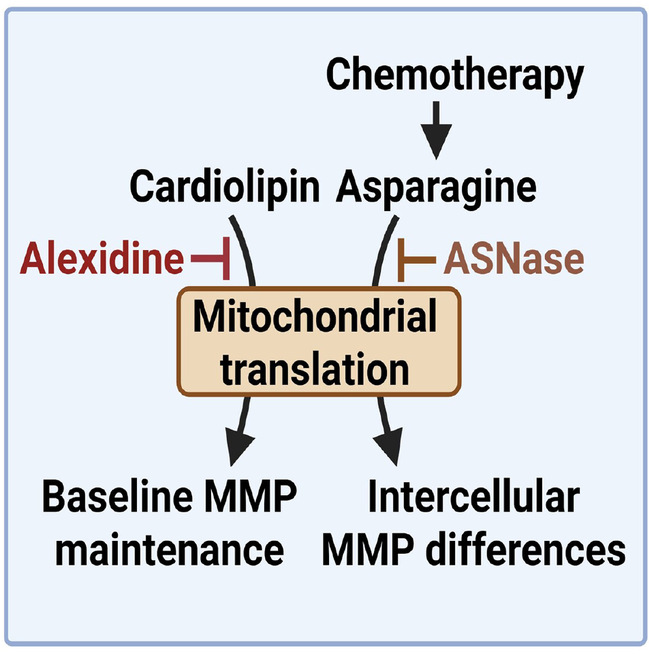
机制研究表明,AD能够特异性结合线粒体内膜的关键脂质成分——不饱和心磷脂。这种结合在短期内(4小时)直接降低MMP,长期(24小时)则通过干扰线粒体超复合物的组装、破坏线粒体内膜核糖体定位,从而特异性抑制线粒体编码蛋白的翻译,降低电子传递链(ETC)活性,最终诱导白血病细胞死亡。敲低线粒体翻译关键因子Mrpl45能重现AD的表型,而临床数据也证实线粒体编码基因高表达与患者不良预后相关。
作用机制二:天冬酰胺驱动MMP异质性及化疗耐药
研究进一步发现,白血病细胞群体内存在MMP异质性(MMP-high与MMP-low)。这种差异并非由心磷脂含量不同引起,而是受内源性代谢物天冬酰胺水平调控。MMP-high的细胞具有更高的天冬酰胺水平、更活跃的线粒体翻译和更强的呼吸能力。化疗后存活的细胞其天冬酰胺水平显著升高。使用天冬酰胺酶(ASNase)消耗天冬酰胺,能够有效降低MMP和线粒体翻译,并显著增强化疗敏感性,延长白血病小鼠生存期。机制上,天冬酰胺通过其氨酰tRNA合成酶Nars2影响线粒体蛋白合成(线粒体编码蛋白本身富含天冬酰胺),从而精细调控MMP。
该研究系统阐释了靶向MMP治疗AML的新策略:一方面,通过药物AD直接靶向心磷脂-线粒体翻译轴;另一方面,揭示了白血病细胞通过感知天冬酰胺水平自主调节MMP以适应压力、产生耐药的代谢新机制。这为克服AML临床耐药提供了双重思路:即开发以AD为代表的靶向MMP药物,以及将ASNase等代谢干预手段与现有化疗方案联合使用。
图片:工作模型
复旦大学代谢与整合生物学研究院刘婷博士后与巩永博博士生为该论文的共同第一作者。本研究还得到了复旦大学代谢与整合生物学研究院赵同金教授、杜兴荣青年研究员、黄林章青年研究员,以及郑州大学李蓬教授的重要支持与帮助。
原文链接:




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台