
我院刘铁民教授课题组与美国加利福尼亚大学洛杉矶分校(UCLA)孔星星教授课题组以及美国哈佛医学院Evan Rosen课题组的合作研究以《棕色脂肪组织通过分泌肌肉生长抑制素调控骨骼肌功能》(Brown Adipose Tissue Controls Skeletal Muscle Function via the Secretion of Myostatin)为题,于2018年8月2日在顶级学术期刊《细胞代谢》(Cell Metabolism)在线发表。该研究揭示了棕色脂肪与骨骼肌之间全新的交互作用和分子关联,拓展了我们对代谢网络在分子、细胞和组织器官水平的认识,为进一步探究糖尿病、肥胖和骨骼肌病等代谢综合征的病理机制和有效治疗策略指出新方向。
骨骼肌和棕色脂肪组织(BAT)是人体利用产热维持体温和能量平衡的两大重要器官,二者具有共同的祖细胞。运动可诱导多种肌肉因子表达,通过旁分泌/内分泌作用于棕色脂肪组织促进其褐变。相反,棕色脂肪能否调控骨骼肌的功能尚未可知。刘铁民教授及其合作者Evan Rosen教授和孔星星教授课题组的前期研究证实,转录因子IRF4是脂肪细胞发育的调节因子,也是BAT线粒体生物合成和产热的关键因子。将BAT中的IRF4敲除(BATI4KO)会降低产热基因的表达和能量消耗,小鼠变的肥胖和不耐受低温(Kong X, Liu T, et al 2014, Cell)。同时,BATI4KO小鼠的运动能力较对照组明显下降,镜下可见股外侧肌出现组织学及超微结构的病理改变,这种异常表现驱动了课题组对其机制的继续探索,也增加了探求BAT如何影响骨骼肌的兴趣和动力。
研究人员提取小鼠股外侧肌线粒体做进一步研究发现,运动功能受损的BATI4KO小鼠其线粒体功能、核糖体蛋白合成和肌肉mTOR信号传导均受抑制。RNA-seq表明棕色脂肪中IRF4的缺失会促进其肌源性基因特征性表达,其中包括分泌因子肌肉生长抑制素(肌抑素是一种明确的肌肉功能抑制剂)。分离小鼠BAT与C2C12体外共培养得到与体内试验一致的结果。将中和性抗体或可溶性ActRIIB受体注入BATI4KO小鼠可降低肌抑素活性并使其运动能力恢复正常。而IRF4在BAT中的过度表达(BATI4OE)则降低了血清中的肌抑素水平,增加了肌肉的线粒体功能和运动能力。为使研究结果置于生理背景下,研究人员将野生型小鼠饲养温度提高至30℃,该条件大大降低了IRF4的表达,这种热中性饲养引起的异常表型与BATI4KO基本一致,表现为运动能力降低、血清肌抑素增加;而上述两种异常改变都可通过手术切除BAT纠正。A)BATI4KO小鼠运动能力下降; B)股外侧肌H&E染色显示细胞核移位;C)管状聚集性肌肉病变;D) RNA-seq表明IRF4的缺失诱导BAT肌源性基因表达;E)MSTN表达增加;F)抗体中和MSTN可恢复运动能力;G)热中性抑制小鼠运动能力;H)手术切除BAT可纠正运动障碍。
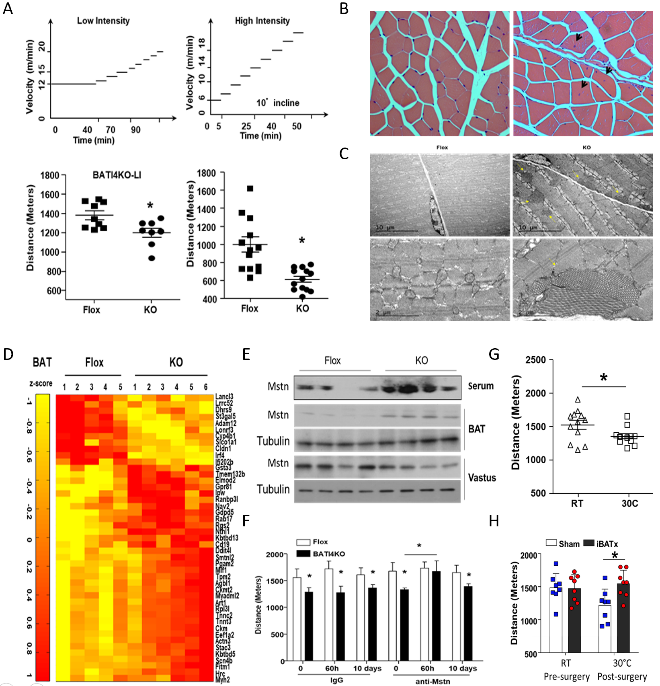
图1 BAT调控骨骼肌功能机制示意图
综合上述实验结果,热中性使BAT释放大量的肌抑素入血,等同于敲除BAT中的IRF4。增加的肌抑素抑制IIB型肌纤维mTOR信号,从而阻遏翻译,包括线粒体电子传递链的组成部分,造成易感肌肉的生物能量缺陷和功能性肌病。研究揭示了棕色脂肪和骨骼肌之间更为深入的、全新的互作关系,为阐明复杂代谢网络的奠定了基础,为更好地认识、解决脂肪及肌肉代谢障碍疾病提供了新思路。

图2 BAT通过分泌MSTN诱发骨骼肌病变、抑制运动功能
该项工作得到了美国国立卫生研究院(NIH)、国家自然科学基金委、遗传工程国家重点实验室、上海市科技创新行动计划等项目的基金资助。孔星星教授及其课题组博士后姚婷为本文的共同第一作者,孔星星教授、刘铁民教授和美国哈佛大学医学院Evan Rosen教授为本文的共同通讯作者。




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台