
2022年4月11日,复旦大学代谢与整合生物学研究院青年研究员任若冰、中国科学院上海生物化学与细胞生物学研究所汪胜研究员和香港中文大学(深圳)助理教授竺立哲合作在国际学术期刊The Proceedings of the National Academy of Sciences在线发表了Structural Insights into Sphingosine-1-phosphate Receptor Activation的研究成果。任若冰课题组博士后玉蕾叶、博士生甘冰,汪胜课题组博士生贺莉聪,竺立哲课题组博士生题如涓为本文共同第一作者。
鞘氨醇-1-磷酸(Sphingosine-1-phosphate, S1P)是高等生物中高度保守的活性鞘脂类代谢物,调节多种细胞过程,如介导淋巴细胞迁移、保持血管的完整性以及产生细胞因子和趋化因子等,对免疫和心血管系统具有重要的作用。S1P信号异常会导致心血管疾病、代谢综合征、自免疫失调、癌症和肾病等多种疾病[1]。S1P通过结合不同的S1P受体亚型(S1PR1-5)激活下游信号通路。S1P的5个受体都属于G蛋白结合的受体A类家族。其中,S1PR1由于能够调节T细胞和B细胞的迁移,受到更广泛的关注和研究,已经成为重要的药物开发靶标蛋白。FTY720-P是最早被开发用于治疗多发性硬化症的药物小分子[2],而小分子CBP-307已经用于治疗溃疡性结肠炎和克罗恩病的临床研究[3]。然而,由于缺少结构的研究,CBP-307与受体的结合和激活受体的机制仍不够清楚。此外,目前已知的S1PR1激动剂大多存在特异性不高的问题,研究不同S1PR1激动剂小分子和S1PR1的结构及相互作用,有助于开发高特异性的靶向S1PR1的药物小分子。
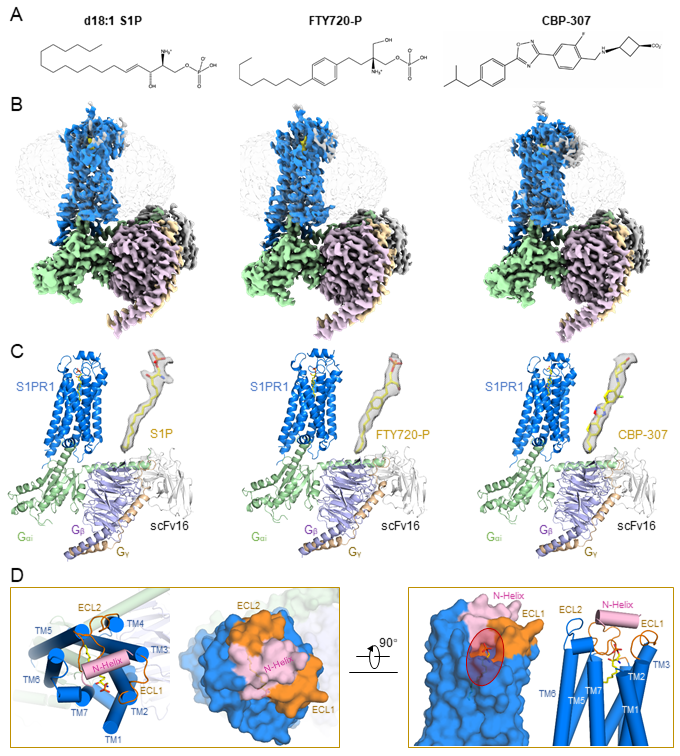
图1 人源S1PR1结合三种激动剂小分子的高分辨率复合体的结构
该研究对S1P、FTY720-P和CBP-307结合识别S1PR1的关键位点、激活机制以及关键配体结合位点对不同激动剂介导的下游信号转导的影响进行了详细的阐释。主要包括:(1)S1P和FTY720-P具有相似的结合S1PR1的模式。两个近乎伸展的分子结合在S1PR1相同的长的顶部亲水底部疏水的配体结合口袋。突变体的功能实验发现配体结合口袋中的E1213.29、R1203.28和N1012.60三个位点是影响S1P和FTY720-P介导的Gi结合与解离的关键位点。另外,配体结合口袋顶部极性氨基酸对于稳定S1P的头部和激活下游Gi信号起到了重要的作用。相比于S1P,配体结合口袋的其它氨基酸位点的突变对于FTY720-P介导的Gi信号影响更小。(2)与非激活态的结构比较显示,S1P激活S1PR1是通过诱导配体结合口袋底部F2105.47和W2696.48等疏水的重要氨基酸的构象的改变,从而引发相关跨膜螺旋的构象变化以及进一步和Gi的结合。(3)和S1P以及FTY720-P相似,CBP-307小分子也是结合在S1PR1的配体口袋,与口袋顶部的极性氨基酸和底部的疏水氨基酸相互作用。不同的是,F125A的突变更显著的影响了CBP-307介导的Gi结合的信号。有趣的是,CBP-307分子被发现存在两种结合在配体口袋的模式:深结合和浅结合。结构分析显示,CBP-307深结合模式和周围氨基酸相互作用更强,分子动力学模拟也进一步证实了结构的分析。本项研究工作首次发现CBP-307的两种结合模式的复合体结构中,Gi的N端螺旋存在5度的旋转。CBP-307深结合模式结构中的Gi的N端螺旋处于更靠近膜的位置,可能有利于稳定复合体。此外,CBP-307激活S1PR1的机制和S1P相似, CBP-307先结合到口袋较浅的位置激活S1PR1,然后,进一步深入结合到口袋内部,进一步的稳定激活态的复合体。(4)两个空的亚口袋被发现存在于S1P结合的S1PR1结构中,其中一个在其它3个解析的结构中也没被占据。这将有助于开发更高选择性和特异性的S1PR1的激动剂。
综上,本项研究利用冷冻电镜单颗粒三维重构技术揭示了S1PR1天然配体激动剂S1P和药物小分子FTY720-P(Fingolimod-P,磷酸化的芬戈莫德)和CBP-307分别结合并激活S1PR1的分子机制,为开发具有更高选择性和高效性的靶向S1PR的药物小分子及相关疾病的治疗提供了重要的参考依据。
论文链接:
https://www.pnas.org/doi/10.1073/pnas.2117716119
参考文献:
Ren RB*, Pang B, Han YF, Li YH. A Glimpse of Structural Biology on Sphingosine-1-Phosphate Metabolism. Contact, 2021, 4: 2515256421995601.
Strader, C.R., Pearce, C.J. & Oberlies, N.H. Fingolimod (FTY720): A Recently Approved Multiple Sclerosis Drug Based on a Fungal Secondary Metabolite. Journal of Natural Products 74, 900-907 (2011).




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台