
我院刘铁民教授课题组与美国加利福尼亚大学洛杉矶分校(UCLA)孔星星教授课题组以及南京医科大学李仲课题组合作,于2020年8月1日在Advanced Science上发表了题为IRF4 in Skeletal Muscle Regulates Exercise Capacity via PTG/Glycogen Pathway(UCLA—复旦大学附属中山医院联合培养博士生朱小鹏为论文第一作者)的研究论文。该研究发现指出,运动训练会影响骨骼肌IRF4表达水平。另一方面,骨骼肌的IRF4则通过糖原靶向蛋白(Protein targeting to glycogen,PTG)调控肌糖原含量、调节肌肉的适应性代谢反应,进而影响运动能力。
肌糖原是体内葡萄糖的主要储存形式。骨骼肌葡萄糖摄取和糖原合成障碍是导致胰岛素抵抗和2型糖尿病(Type 2 diabetes mellitus,T2DM)的主要原因。肌糖原储量对长时间的有氧运动和短时间的高强度间歇运动都是必要的。运动能力会随着肌糖原的消耗而降低,然而,这一系列现象背后潜在的机制却尚未明确。
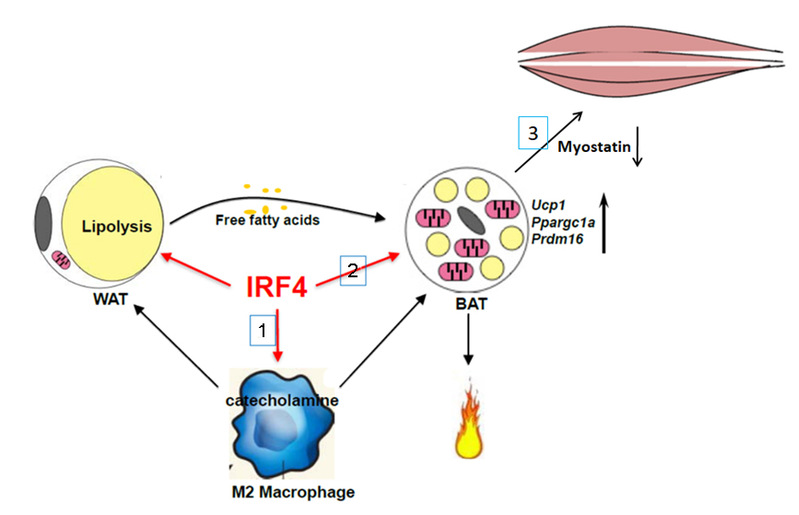
干扰素调节因子4(Interferon regulatory factor 4,IRF4),是一种分子量为52kD的转录因子蛋白,具有重要的免疫调节作用。自哈佛大学的Evan Rosen教授创新性指出IRF4是脂肪细胞发育和脂类分解中的关键因子后,加州大学洛杉矶分校(UCLA)孔星星教授进一步发现IRF4在棕色脂肪的热量生成、能量消耗和低温耐受中发挥重要作用,为IRF4的代谢调控分子机制开辟了更为开阔的研究思路。已有研究发现:白色脂肪组织(WAT)中的IRF4可通过调节巨噬细胞M1/M2极化调控肥胖引起的炎症[1];棕色脂肪组织中(BAT)的IRF4能与PGC-1α直接相互作用、促进UCP1的表达和热量生成[2],此外,还通过分泌蛋白Myostatin调控骨骼肌功能[3]。
研究发现与正常饮食的对照小鼠相比,骨骼肌特异性IRF4基因敲除(MI4KO)小鼠肌糖原水平升高,运动能力增强,但是体重、糖耐量、胰岛素敏感性无显著差异。相反,骨骼肌特异性过表达IRF4(MI4OE)小鼠肌糖原水平降低,更易发生运动疲劳。进一步机制研究表明,PTG是IRF4影响骨骼肌糖原合成的潜在介质。MI4KO小鼠骨骼肌敲低PTG可降低肌糖原水平,减弱跑步能力,逆转骨骼肌缺乏IRF4所导致的表型。
本研究首次揭示IRF4是机体骨骼肌运动代谢适应的信号节点,可通过激活下游靶蛋白PTG促进骨骼肌糖原合成的重新编程、调节运动能力。已知运动在防治代谢性疾病方面的众多益处,然而确定模拟或促进耐力训练的药物分子靶点一直以来都是较难实现的医学目标。该研究初步表明IRF4在调节骨骼肌能量代谢方面具有重要作用,有助于从分子水平理解运动时机体调节能量代谢的具体制,同时为防治慢性代谢疾病提供新的思路。

论文链接:
https://doi.org/10.1002/advs.202001502
参考文献:
Eguchi J, Kong X X, Tenta M, Wang X, Kang S N, Rosen E D. Diabetes, 2013, 62, 3394.
Kong X X, Banks A, Liu T, Kazak L, Rao R R, Cohen P, Wang X, Yu S, Lo J C, Tseng Y H, Cypess A M, Xue R, Kleiner S, Kang S, Spiegelman B M, Rosen E D. Cell, 2014, 158, 69.
Kong X, Yao T, Zhou P, Kazak L, Tenen D, Lyubetskaya A, Dawes B A, Tsai L, Kahn B B, Spiegelman B M, Liu T, Rosen E D. Cell Metabolism, 2018, 28, 631.




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台