
内质网(Endoplasmic reticulum, ER)是真核细胞内膜系统的重要组成部分,是细胞内蛋白质、脂质、寡糖合成和修饰的重要场所。在蛋白质质量控制、细胞内膜泡运输、钙离子稳态调节以及细胞器间通讯中,内质网发挥着不可或缺的作用,是真核细胞维持机体正常的生理功能必不可少的细胞器[1]。内质网自噬(ER-phagy)作为一种选择性自噬机制,能响应细胞内外环境刺激,选择性地将特定内质网片段运送到溶酶体中,来清除难溶蛋白质聚集物和冗余脂质组分,进而维持内质网稳态[2]。内质网自噬异常可引发多种人类重大疾病,如肿瘤、自身免疫性疾病、心血管病、神经系统疾病等[3]。因此,内质网自噬对内质网质量控制和机体稳态维持至关重要。然而,关于其发生的分子机制仍知之甚少。
细胞自噬(macroautophagy)发生的标志性事件是双层膜的自噬体(autophagosome)的形成。一系列核心自噬蛋白质机器(core autophagy machinery)包括自噬起始蛋白激酶ULK1复合物、ATG9囊泡、Ⅲ型磷脂酰肌醇3-激酶PI3KC3-C1复合物、PI(3)P结合蛋白WIPI、脂质转运蛋白ATG2、类E1酶ATG7、类E2酶ATG3、类E3连接酶ATG12-ATG5-ATG16复合物、LC3家族蛋白等协同互作共同介导自噬体形成[4]。而内质网自噬发生时,这些核心自噬蛋白质机器如何被招募到特定的内质网区域,包裹待降解的内质网片段,并起始内质网自噬体的从头组装尚不清楚。
近日,复旦大学代谢与整合生物学研究院常春美课题组与合作团队在PNAS上发表了题为“ER membrane receptors engage core autophagy machinery to initiate ER phagy”的研究论文,揭示了内质网自噬受体在驱动自噬体从头组装中的关键作用及其分子机制。

不同类型的选择性自噬包括内质网自噬,其特异性由一系列自噬受体决定。这些受体通过与底物和自噬体膜上脂质化LC3结合,实现自噬体膜对于不同底物的识别[5]。最近研究表明自噬受体不仅仅是被动的桥梁,它们在自噬体发生的上游也可能发挥重要作用[6]。目前已在哺乳动物中鉴定出六种膜驻留的内质网自噬受体,它们响应不同的信号,介导对特定内质网片段的选择性清除[7]。为了探究这些膜蛋白受体在内质网自噬起始中的作用,研究人员首先纯化了不同的内质网自噬受体蛋白和一系列核心自噬相关复合物,并建立了体外bead结合实验来系统检测不同受体与核心自噬蛋白的相互作用,发现不同内质网自噬受体包括FAM134B、SEC62、TEX264和ATL3与核心自噬蛋白ATG9和WIPI2能直接相互作用,且结合能力较强。
研究人员分别对这两组相互作用进行了深入解析,发现一方面内质网自噬受体通过直接与ATG9胞外段的一段ɑ螺旋(氨基酸525–608)结合,形成内质网上最初的自噬体成核位点,进一步招募包括ULK1复合物,PI3KC3-C1复合物和ATG2等其他核心自噬机器,起始自噬体的从头组装。
另外一方面,这些受体能直接与WIPI2第二个叶片结构域(blade 2)的EINSY残基结合,与已知的ATG16或PI3P结合位点不同,表明内质网自噬受体通过独特界面与WIPI2互作。利用研究组建立的体外LC3脂质化重构GUV体系,研究人员发现内质网自噬受体通过招募WIPI2进一步招募LC3脂质化机器, 从而诱导LC3脂质化发生, 促进自噬体膜的快速延伸。
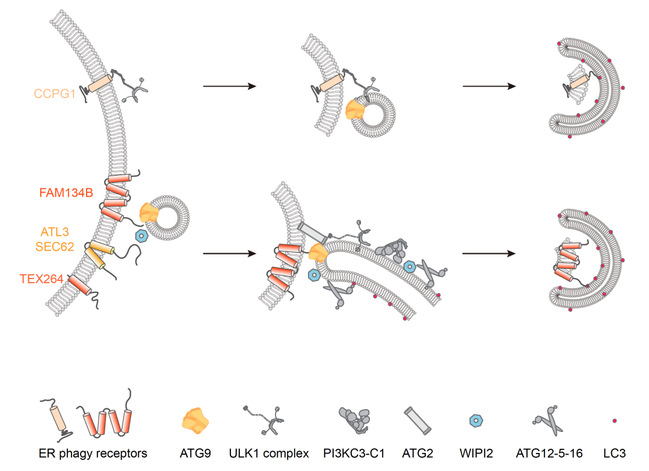
图:内质网自噬受体驱动自噬体从头组装的模式图
综上所述,本研究将体外重构体系与细胞内自噬功能研究相结合,发现内质网自噬受体通过直接招募核心自噬蛋白质机器驱动自噬体的从头组装,不同的受体蛋白能结合不同的核心自噬蛋白,揭示了内质网自噬受体在自噬体形成不同环节中的重要作用。该研究发现加深了对内质网自噬发生的分子机制的理解,为探究相关疾病的机理提供了重要理论依据。
复旦大学代谢与整合生物学研究院吴姹和杨海霞博士为该论文的共同第一作者,复旦大学代谢与整合生物学研究院常春美青年研究员和同济大学医学院卢毅研究员为共同通讯作者,复旦大学代谢与整合生物学研究院任若冰青年研究员和浙江大学国际健康研究院刘伟教授为本研究提供了重要帮助和支持。
原文链接:
https://doi.org/10.1073/pnas.2523465123
参考文献:
L. M. Westrate, J. E. Lee, W. A. Prinz, G. K. Voeltz, Form follows function: the importance of endoplasmic reticulum shape. Annu Rev Biochem 84, 791-811 (2015).
H. Chino, N. Mizushima, ER-Phagy: Quality Control and Turnover of Endoplasmic Reticulum. Trends Cell Biol 30, 384-398 (2020).
S. Ferro-Novick, F. Reggiori, J. L. Brodsky, ER-Phagy, ER Homeostasis, and ER Quality Control: Implications for Disease. Trends Biochem Sci 46, 630-639 (2021).
C. Chang, L. E. Jensen, J. H. Hurley, Autophagosome biogenesis comes out of the black box. Nat Cell Biol 23, 450-456 (2021).
V. Kirkin, V. V. Rogov, A Diversity of Selective Autophagy Receptors Determines the Specificity of the Autophagy Pathway. Mol Cell 76, 268-285 (2019).
E. Adriaenssens, L. Ferrari, S. Martens, Orchestration of selective autophagy by cargo receptors. Curr Biol 32, R1357-R1371 (2022).
A. Gubas, I. Dikic, ER remodeling via ER-phagy. Mol Cell 82, 1492-1500 (2022).




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台