
牛磺酸(taurine)是一种含硫的非蛋白合成氨基酸,其核心生物学功能是参与线粒体tRNA U34位点的τm⁵(s2)U修饰进而维持线粒体编码蛋白的高保真翻译[1]。早在2002年,Takeo Suzuki团队就发现牛磺酸被转运进入线粒体参与τm⁵(s2)U34修饰[2],但线粒体牛磺酸转运体至今未被鉴定。哺乳动物细胞既可通过细胞膜牛磺酸转运体SLC6A6摄取外源性牛磺酸,又可通过胞质CDO1-CSAD等通路从头合成[3]。哺乳动物细胞内牛磺酸浓度通常高达毫摩尔水平,显著高于循环系统中的微摩尔水平[4]。在肿瘤微环境中,胃癌细胞与T细胞竞争外源牛磺酸促进逃逸免疫[5],而基质细胞合成的牛磺酸通过驱动白血病细胞糖酵解促进疾病进展[6]。然而,快速增殖的肿瘤细胞中牛磺酸主要来源于外源摄取还是内源合成,其线粒体内转运与利用如何被精确调控,目前仍不清楚。
2026年2月6日,复旦大学代谢与整合生物学研究院李福明、陈立课题组联合中国科学院分子细胞科学卓越创新中心周小龙课题组在国际知名期刊Nature Metabolism在线发表了题为“SLC6A6 imports taurine into mitochondria to sustain mitochondrial translation and tumour growth”的研究论文。该研究首次鉴定了SLC6A6作为线粒体牛磺酸转运体并通过线粒体tRNA修饰驱动肿瘤进展。研究还发现,肝癌和肺癌细胞生长主要依靠内源牛磺酸合成而非外源摄取;蛋白激酶A(PKA)调节SLC6A6亚细胞定位,而NFAT5在转录水平调节SLC6A6表达;靶向NFAT5-SLC6A6轴可显著限制线粒体翻译与肿瘤进展(图1)。
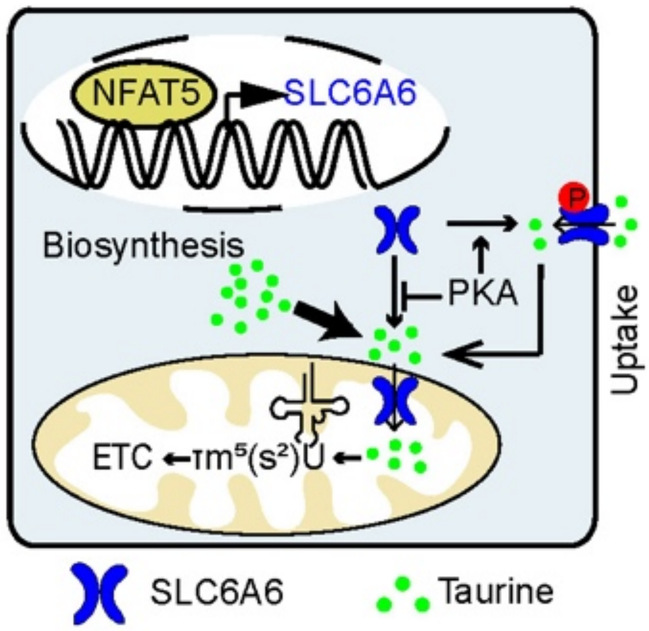
图1:SLC6A6介导线粒体牛磺酸转运的工作模式图。
首先,为探究外源性牛磺酸对肿瘤细胞生长的影响,研究人员比较了肝癌和肺癌细胞在常规含血清培养基(D10)以及不含牛磺酸的血清替代物培养基(D-N2/B27)中的生长,发现D-N2/B27培养基中的细胞增殖不受影响,甚至具有更强的克隆形成能力(图2A,B)。同时,采用同位素标记的胱氨酸示踪实验,发现超过50%的牛磺酸中均可检测到同位素标记(图2C)。上述结果提示,半胱氨酸是牛磺酸生物合成的前体,而外源牛磺酸不是肿瘤细胞增殖必需的营养物。
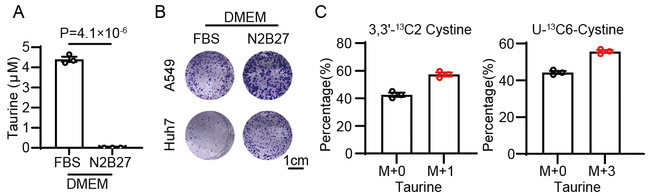
图2:外源性牛磺酸对肿瘤细胞的生长并非必需。(A)LC-MS测定D10或D-N2B27中牛磺酸丰度。
(B)肿瘤细胞在D10或D-N2B27培养条件下的克隆形成实验结果。(C)同位素标记胱氨酸示踪牛磺酸合成。
研究人员发现,在没有外源牛磺酸的培养条件下,敲低细胞膜牛磺酸转运体基因SLC6A6仍显著抑制肿瘤细胞增殖(图3A),降低其耗氧率(OCR)(图3B);同时,SLC6A6敲降细胞中线粒体tRNALeu(UUR)和tRNATrp的τm⁵(s2)U34修饰水平显著降低(图3C),体内肿瘤生长被遏制(图3D)。该结果表明,SLC6A6对线粒体功能、细胞增殖及肿瘤生长具有关键作用。
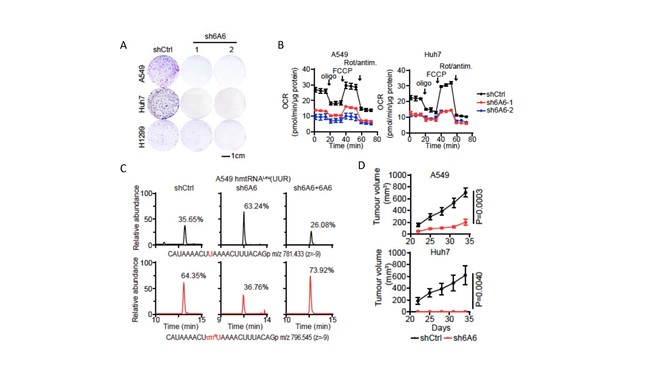
图3:SLC6A6介导线粒体牛磺酸转运维持线粒体稳态与癌细胞生长。
(A)对照和SLC6A6敲低细胞的克隆形成实验结果。(B) Seahorse能量代谢分析结果。
(C)各组细胞线粒体tRNALeu(UUR)含有τm⁵(s2)U34片段占比(%)。(D)对照组与SLC6A6敲低组细胞的异种移植瘤生长曲线。
研究人员采用共聚焦成像结合线粒体分离技术,发现SLC6A6除了细胞膜定位外还具有线粒体定位(图4A),并进一步通过体外线粒体牛磺酸吸收等实验证实,SLC6A6是关键的线粒体牛磺酸转运体。同时,小鼠肝脏特异敲除SLC6A6降低了线粒体编码蛋白水平和线粒体牛磺酸含量,却不影响肝脏整体的牛磺酸丰度(图4B, C)。因此,SLC6A6的主要功能是介导线粒体牛磺酸转运而非外源牛磺酸吸收。
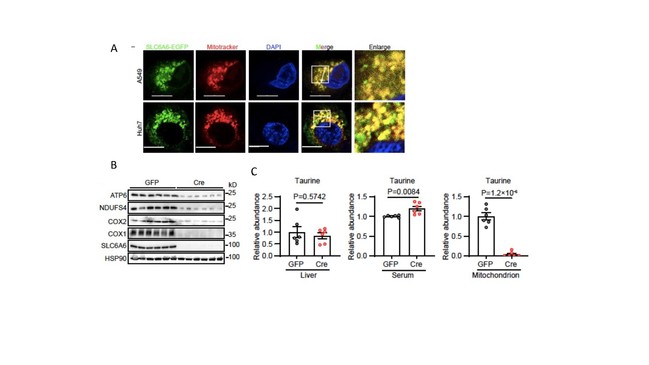
图4:SLC6A6介导线粒体牛磺酸转运。(A)SLC6A6-EGFP在不同癌细胞系中与MitoTracker的共定位。比例尺:10微米。
(B)GFP与Cre(Slc6a6 KO)组小鼠肝组织的免疫印迹分析。(C)GFP与Cre组小鼠肝脏组织、血清及肝线粒体中牛磺酸相对丰度分析。
研究人员进一步对SLC6A6的亚细胞定位以及表达调控机制进行了探究,最终发现PKA通过SLC6A6 S21/25位点磷酸化促进其细胞膜定位和限制其线粒体分布,而NFAT5则在转录水平调控SLC6A6表达。最后利用肺癌小鼠模型证实,NFAT5小分子抑制剂KRN2通过降低SLC6A6表达限制线粒体翻译进而有效地遏制肿瘤进展。
总之,本研究鉴定了SLC6A6作为主要的线粒体牛磺酸转运体,证实其通过线粒体tRNA修饰促进线粒体翻译并驱动肿瘤进展,明确了牛磺酸的亚细胞转运机理及促癌功能。本研究还发现NFAT5是调控肿瘤线粒体代谢的新型转录因子;NFAT5和SLC6A6的转录水平与多种癌症患者的不良预后显著相关,结果提示靶向NFAT5-SLC6A6信号轴具有抑制线粒体翻译和抗肿瘤潜力。
复旦大学代谢与整合生物学研究院李福明副教授、陈立副教授和中国科学院分子细胞科学卓越创新中心周小龙研究员为本文共同通讯作者;复旦大学代谢与整合生物学研究院李留成博士、游建伟博士和中国科学院大学杭州高等研究院柴子晴博士(周小龙课题组)为本文共同第一作者。该研究受到科技部重点研发计划、国家自然科学基金委面上项目、中国科学院战略性先导科技专项和中国科学院青年基础研究项目的支持。本研究同时得到了复旦大学人类表型组研究院刘苹羽课题组、复旦大学代谢与整合生物学研究院赵同金课题组、复旦大学基础医学院李飞课题组、中国科学院分子细胞科学卓越创新中心季红斌课题组、清华大学陈立功课题组,以及复旦大学代谢与整合生物学研究院仪器平台的大力支持。
李福明课题组长期从事肿瘤代谢研究,近年来聚焦氨基酸代谢与肿瘤,围绕氨基酸转运与线粒体稳态、氨基酸分解与能量代谢及表观遗传修饰取得系列成果;以通讯作者(含共通讯)身份在Nat Metab(2026)、Mol Cell(2025)、Nat Chem Biol(2025)和Nat Cancer(2024)等杂志发表多篇论文。实验室长期招收博士后,欢迎感兴趣者邮件联系(fuming_li@fudan.edu.cn)。
原文链接:
https://www.nature.com/articles/s42255-026-01455-6
参考文献:
Stipanuk, M.H., Dominy, J.E., Jr., Lee, J.I. & Coloso, R.M. Mammalian cysteine metabolism: new insights into regulation of cysteine metabolism. J Nutr 136, 1652S–1659S (2006).
Suzuki, T. et al. Complete chemical structures of human mitochondrial tRNAs. Nat Commun 11, 4269 (2020).
Baliou, S. et al. Significance of taurine transporter (TauT) in homeostasis and its layers of regulation (Review). Mol Med Rep 22, 2163–2173 (2020).
Ueki, I. et al. Knockout of the murine cysteine dioxygenase gene results in severe impairment in ability to synthesize taurine and an increased catabolism of cysteine to hydrogen sulfide. Am J Physiol Endocrinol Metab 301, E668–684 (2011).
Cao, T. et al. Cancer SLC6A6-mediated taurine uptake transactivates immune checkpoint genes and induces exhaustion in CD8(+) T cells. Cell 187, 2288–2304 e2227 (2024).
Sharma, S. et al. Taurine from tumour niche drives glycolysis to promote leukaemogenesis. Nature 644, 263–272 (2025).




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台