
棕色脂肪组织(BAT)是哺乳动物进行非颤抖性产热的重要器官[1],通过解偶联蛋白1(UCP1)解偶联线粒体质子梯度氧化燃料产生热量从而维持体温[2]。激活BAT可以通过增加葡萄糖和脂质清除来调节葡萄糖稳态以及胰岛素敏感性[3-8],因此,针对BAT的激活可以作为治疗糖脂代谢紊乱等相关代谢性疾病的潜在策略[3]。然而,当机体处于急性冷刺激暴露时,尚不清楚BAT是如何快速启动产热功能。
DDB1(Damage-specific DNA binding protein 1)是一种多功能蛋白,通常与CUL4形成泛素连接酶复合物,行使调控DNA损伤修复以及细胞增殖、存活等多种生物学功能[9-12]。赵同金课题组在前期工作中研究发现了DDB1能够以不依赖于CUL4 E3 泛素连接酶的功能调控白色脂肪细胞的分化事件[13]。
2022年5月13日,复旦大学代谢与整合生物学研究院赵同金课题组在Life Metabolism杂志上发表了题为DDB1 Prepares Brown Adipocytes for Cold-Induced Thermogenesis的研究论文,发现了棕色脂肪细胞中DDB1通过释放暂停的Pol II开启即时响应产热基因转录事件的分子机制,揭示了DDB1在调控棕色脂肪组织应对急性冷刺激下快速产热的生理作用。
作者研究发现成熟脂肪细胞以及棕色脂肪细胞特异性Ddb1缺失小鼠的BAT严重白色脂肪样化,并且在急性冷刺激下小鼠不能够维持体温而死亡,证明BAT缺失DDB1导致产热功能出现严重障碍。进一步研究发现,DDB1同样能够以不依赖于CUL4的形式维持BAT的棕色化形态及产热功能,而且DDB1对于产热最早期基因的表达是必需的。随后通过RNA-Seq和ChIP-Seq等手段,作者发现DDB1能够结合在Ucp1和Ppargc1a的启动子之上,通过招募正转录延伸因子P-TEFb,释放启动子近端暂停的RNA聚合酶II(Pol II),从而在急性冷刺激时实现产热基因的快速同步转录。因此,研究人员的发现为BAT如何应对急性冷刺激提供了一种调节机制。
Pol II pausing release调控多种发育以及应激相关的即时响应基因的转录[14],在之前研究工作中作者证明了DDB1能够通过Pol II pausing release调控白色脂肪细胞分化的最早期转录事件。在本研究中,作者发现DDB1能够与CREB结合到Ucp1和Ppargc1a等产热早期基因启动子上,当受到冷刺激信号时,DDB1招募正向转录延伸因子b(P-TEFb)到这些基因启动子区域,活化并释放暂停的Pol II,从而开启棕色脂肪细胞产热的早期转录事件(图1)。
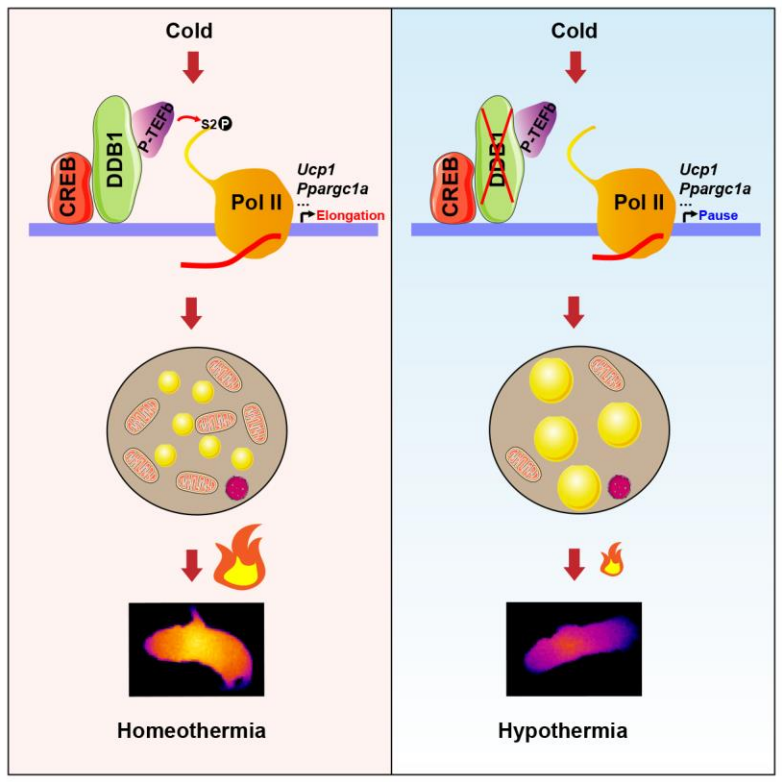
图1 BAT中DDB1应对冷刺激的调控机制
该研究揭示了DDB1能够以不依赖于CUL4的方式调控棕色脂肪细胞在急性冷刺激下,快速产热过程的分子机制,并发现了Pol II pausing release在调控棕色脂肪细胞产热的生理作用。
复旦大学代谢与整合生物学研究院博士后王旭、博士生刘莘颖,厦门大学药学院博士生胡国升为该论文的共同第一作者,复旦大学代谢与整合生物学研究院赵同金教授为本研究的通讯作者。同时,该课题获得了清华大学/复旦大学李蓬院士课题组,厦门大学刘文课题组,以及复旦大学代谢与整合生物学研究院叶浩彬课题组的大力支持。
论文链接:
https://academic.oup.com/lifemeta/advance-article/doi/10.1093/lifemeta/loac003/6584503
参考文献:
Cannon, B., Nedergaard, J. Brown adipose tissue: function and physiological significance. Physiol Rev, 2004, 84(1): 277-359.
Enerback, S., Jacobsson, A., Simpson, E.M., Guerra, C., Yamashita, H., Harper, M.E., and Kozak, L.P. Mice lacking mitochondrial uncoupling protein are cold-sensitive but not obese. Nature, 1997, 387(6628): 90-94.
Peirce, V., and Vidal-Puig, A. Regulation of glucose homoeostasis by brown adipose tissue. Lancet Diabetes Endocrinol, 2013, 1(4): 353-360.
Shamsi, F., Wang, C.H., and Tseng, Y.H. The evolving view of thermogenic adipocytes - ontogeny, niche and function. Nat Rev Endocrinol, 2021,17(12): 726-744.
Stanford, K.I., Middelbeek, R.J., Townsend, K.L., An, D., Nygaard, E.B., Hitchcox, K.M., Markan, K.R., Nakano, K., Hirshman, M.F., Tseng, Y.H., et al. Brown adipose tissue regulates glucose homeostasis and insulin sensitivity. J Clin Invest, 2013,123(1): 215-223.
van Marken Lichtenbelt, W.D., Vanhommerig, J.W., Smulders, N.M., Drossaerts, J.M., Kemerink, G.J., Bouvy, N.D., Schrauwen, P., and Teule, G.J. Cold-activated brown adipose tissue in healthy men. N Engl J Med, 2009, 360(15):1500-1508.
Virtanen, K.A., Lidell, M.E., Orava, J., Heglind, M., Westergren, R., Niemi, T., Taittonen, M., Laine, J., Savisto, N.J., Enerback, S., et al. Functional brown adipose tissue in healthy adults. N Engl J Med, 2009, 360(15): 1518-1525.
Saito, M., Okamatsu-Ogura, Y., Matsushita, M., Watanabe, K., Yoneshiro, T., Nio-Kobayashi, J., Iwanaga, T., Miyagawa, M., Kameya, T., Nakada, K., et al. High incidence of metabolically active brown adipose tissue in healthy adult humans: effects of cold exposure and adiposity. Diabetes, 2009, 58(7): 1526-1531.
Jennifer Lee, Pengbo Zhou. DCAFs, the missing link of the CUL4-DDB1 ubiquitin ligase. Mol Cell, 2007,26(6):775-80.
Jin J, Arias EE, Chen J, et al. A family of diverse Cul4-Ddb1-interacting proteins includes Cdt2, which is required for S phase destruction of the replication factor Cdt1. Mol Cell, 2006,23(5):709-21.
Angers S, Li T, Yi X, et al. Molecular architecture and assembly of the DDB1-CUL4A ubiquitin ligase machinery. Nature, 2006, 443(7111):590-3.
Groh BS, Yan F, Smith MD, et al. The antiobesity factor WDTC1 suppresses adipogenesis via the CRL4WDTC1 E3 ligase. EMBO Rep, 2016, 17(5):638-47.
Wang, X., Wang, H.Y., Hu, G.S. et al. DDB1 binds histone reader BRWD3 to activate the transcriptional cascade in adipogenesis and promote onset of obesity. Cell Rep, 2021, 35(12): 109281.
Levine, M. Paused RNA polymerase II as a developmental checkpoint. Cell, 2011, 145(4):502-11.




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台