
线粒体DNA耗竭综合征(Mitochondrial DNA Depletion Syndrome, 简称MTDPS)是一组罕见的遗传疾病,其特点是患者细胞内的线粒体DNA含量显著降低。MTDPS可以分为多个亚型,其中最常见的亚型是由于缺乏线粒体DNA复制酶或DNA修复酶所导致的。这些酶的缺陷会干扰线粒体DNA的复制和修复过程,使得线粒体内的DNA逐渐减少。由于线粒体DNA在编码线粒体蛋白质所需的基因中起着关键作用,MTDPS患者往往出现线粒体蛋白质的缺乏或功能异常。这会导致细胞能量代谢受损,进而影响多个器官和组织的功能。临床表现方面,MTDPS患者常常表现为全身性疾病,包括肌无力、肝功能异常、神经系统障碍等。病情的严重程度和症状的种类可以因亚型的不同而有所差异。
2023年8月12日(当地时间),复旦大学生命科学学院王陈继团队、基础医学院马丽香团队、附属妇产科医院/代谢与整合生物学研究院赵世民团队与上海市儿童医院陈育才团队合作,于Cell Death & Differentiation期刊发表题为FBXL4 mutations cause excessive mitophagy via BNIP3/BNIP3L accumulation leading to mitochondrial DNA depletion syndrome的研究论文。该研究发现FBXL4基因突变导致线粒体自噬(mitophagy)受体BNIP3和BNIP3L蛋白异常积累,线粒体自噬过度激活,进而导致线粒体数目急剧下降,是其突变致病的内在分子机制。

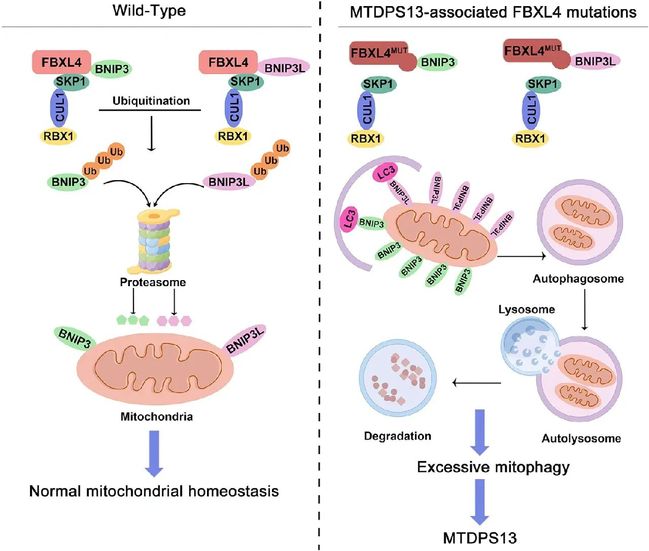
Cullin家族E3泛素连接酶底物亚基—FBXL4是新发现的一个MTDPS亚型(MTDPS13)致病基因。病人的临床表型主要表现为高乳酸血症,发育迟缓和肌张力减退为特征的多系统疾病,其他特征包括喂养困难、小头畸形、高氨血症、癫痫发作、肥厚型心肌病、肝转氨酶升高、复发性感染和面部特征多样等。目前尚无有效的治疗策略。因此,阐明FBXL4突变致病的分子机制,寻找有效的靶向干预治疗手段是亟待解决的临床难点问题。
鉴于FBXL4是一个Cullin家族E3泛素连接酶底物亚基,研究人员首先猜测FBXL4可能参与了和线粒体稳态维持相关蛋白的泛素化修饰调控。通过蛋白质亲和纯化质谱技术,研究人员发现BNIP3和BNIP3L是FBXL4的潜在互作蛋白。BNIP3和BNIP3L属于BCL-2家族的成员,是定位在线粒体外膜的膜蛋白。它们的转录表达受到低氧诱导因子HIF1α所调控。当细胞处于低氧状态时,BNIP3和BNIP3L的表达水平上调。它们通过与自噬核心蛋白LC3/GABARAPs结合,促进线粒体与自噬体的结合并降解。这种选择性的线粒体自噬有助于维持细胞内线粒体的数量和和功能,从而维持细胞的稳态。
后续的实验证实,BNIP3/3L蛋白的半衰期很短,泛素化降解作用活跃。FBXL4可以和BNIP3/3L特异性结合,并促进其通过蛋白酶体途径的泛素化降解。细胞中FBXL4敲除导致的线粒体数目显著下降和代谢异常表型可以被同时敲减BNIP3/3L的表达所逆转。MTDPS13病人来源的FBXL4错义突变体不能正确组装成CUL1-RBX1-FBXL4 E3泛素连接酶复合体,导致BNIP3/3L的泛素化降解受阻。异常积累的BNIP3/3L导致细胞在非应激条件下即存在过度的线粒体自噬,线粒体数目显著下降,从而导致患者神经系统在内的多系统异常临床表型(图1)。
注:插图源于Cell Death & Differentiation
为了进一步确证上述分子机制,研究人员从一名FBXL4移码突变(p.L332Tfs*3)的MTDPS13患者获取外周血单核细胞,然后通过重编程技术诱导成多能干细胞(iPSCs),然后将iPSCs分化为神经前体细胞(NPCs)或成熟皮质神经元(Cortical Neurons)。进一步检测发现, FBXL4突变的神经前体细胞或皮质神经元中,BNIP3/3L蛋白异常累积,并且表现出的远高于对照的线粒体自噬发生。此外根据病人突变位点构建的位点敲入小鼠模型也证实FBXL4突变导致小鼠脑、心、肝和肺等多器官中BNIP3/3L蛋白异常累积和线粒体数量显著降低。在FBXL4突变小鼠的成纤维细胞(MEFs)中同时敲低BNIP3/3L的表达即可逆转自发性的高水平线粒体自噬。由此,在小鼠模型和病人来源的iPSCs诱导分化的神经细胞体系得到的结果进一步支持了上述分子机制。
最后,研究人员讨论了该病潜在的靶向治疗手段。鉴于BNIP3/3L的异常积累是MTDPS13的致病原因,后续可通过PROTAC技术设计并合成促进BNIP3/3L的靶向降解的小分子,降低突变细胞内的BNIP3/3L的蛋白水平来抑制过高的线粒体自噬,从而实现靶向治疗的目的。此外,某些已知的抑制线粒体自噬的小分子,如mDivi-1等,也有拮抗BNIP3/3L积累导致的高水平线粒体自噬的应用潜力。
总之,这项工作将从“FBXL4-BNIP3/3L-mitophagy”调节轴的全新角度诠释FBXL4突变引起线粒体DNA耗竭综合征的分子机制,为后续的靶向治疗提供了坚实的理论依据。
原文链接:




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台