
鞘氨醇-1-磷酸(Sphingosine-1-phosphate, S1P)是真核生物中重要的活性鞘脂代谢物,在介导淋巴细胞迁移和保持血管完整性中起着重要的作用。细胞内S1P促进细胞增殖,胞外S1P促进免疫细胞运输,调节血管生成等[1]。由于S1P磷酸基团的电负性,使其不能够通过自由扩散被动穿过细胞膜,因此如何实现S1P主动跨膜转运并释放到细胞外,就成为其能否发挥生理学功能的重要调控步骤。在过去的二十年里,已经鉴定了几种S1P转运蛋白,包括两个MFS蛋白超家族成员:Spns2和Mfsd2b,以及一些ABC转运超家族转运蛋白,Spns2是最早被鉴定和研究最广泛的S1P转运蛋白。具有重要生理学功能的主动跨膜转运蛋白的结构生物学和生物化学研究一直是领域内的热点和难点,因此利用结构生物学及生物化学手段,从分子机制上理解S1P的跨膜转运过程,对于深入了解S1P代谢异常疾病的发病机理,以及针对此类疾病进行靶向药物开发都具有重要意义。
2023年12月20日,复旦大学代谢与整合生物学研究院青年研究员任若冰课题组与青年研究员陈立课题组、青年研究员戴薇课题组合作,在Cell Research杂志在线发表了文章Molecular basis of Spns2 facilitated sphingosine-1-phosphate transport,报道了S1P转运蛋白Spns2跨细胞膜转运S1P的结构基础和抑制机制。任若冰课题组博士生庞滨、博士后玉蕾叶,戴薇课题组博士生李通为本文共同第一作者,复旦大学代谢与整合生物学研究院为第一完成单位。
该研究利用冷冻电镜单颗粒三维重构技术报道了人源Spns2结合底物S1P及抑制剂16d的胞内开放构象。同时,结合质谱利用基于细胞的S1P外流体外实验(该方法部分工作2023年8月在Biochemical and Biophysical Research Communications杂志发表[2],复旦大学代谢与整合生物学研究院为第一完成单位)及评估斑马鱼心脏发育的体内实验(Spns2的敲除导致斑马鱼出现双心表型),进行了Spns2关键氨基酸突变的功能研究,以破译Spns2识别S1P和转运S1P构象变化的关键残基。
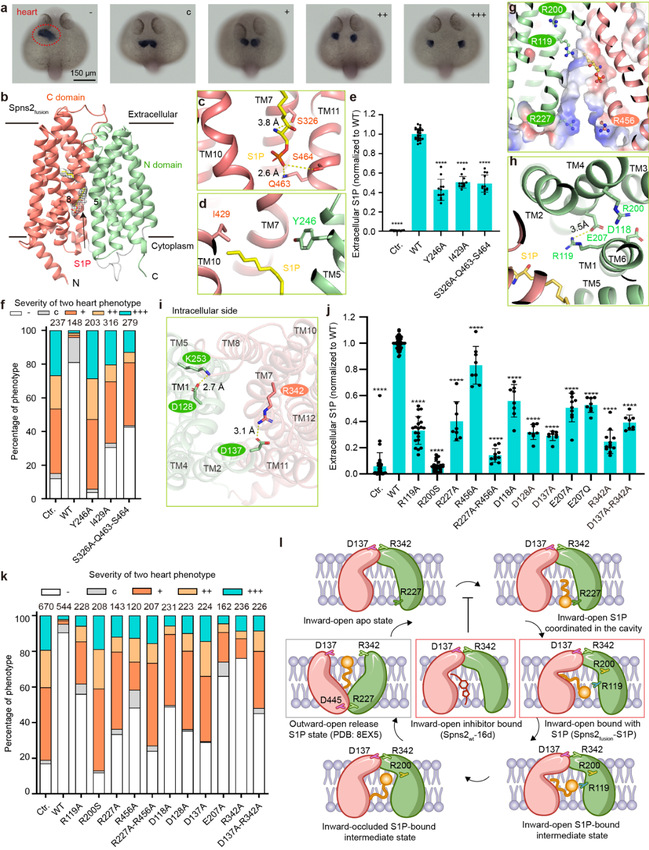
图1 结合S1P的Spns2的冷冻电镜结构和Spns2介导的S1P转运生化特性
结合S1P的Spns2由氨基末端结构域(NTD,包括TM1-TM6)和羧基末端结构区(CTD,包括TM7-TM12)组成的向内开放构象。两个结构域由一个长的柔性细胞质环和一个短的细胞内螺旋连接。S1P的磷酸基团与Spns2形成广泛的极性相互作用,特别是TM11上的Q463和S464残基,S1P的氨基与TM7上的S326相互作用。S1P的烷基尾部插入TM7-10上主要由疏水残基组成的口袋中,Y246和I429与S1P的烷基尾部相互作用。R227和R456位于空腔的细胞质入口,而R119位于空腔的中部,R200位于空腔外部靠近R119。残基D118、R119、R200和E207形成氢键网络,以稳定NTD的局部构象。此外,靠近细胞外侧的D137-R342和D128-K253之间的盐桥也可能在稳定Spns2的内向开放构象方面发挥关键作用。综合生化实验证明了这些位点在Spns2的S1P转运活性中的关键作用,并通过蛋白质印迹和免疫荧光定位验证了上述突变体的表达水平和质膜定位。此外,该研究还证实对S1P转运影响的突变体也显著降低了FTY720-P的转运活性,这表明与S1P类似的FTY720-P转运机制。该研究同时解析了Spns2结合抑制剂16d胞内开口构象的结构,并对最新报道的抑制剂33p进行了IC50测定。
综上,研究发现正电荷残基R227和R119对S1P转运至关重要,并可作为“支架”促进S1P的磷酸基团从细胞内侧翻转到细胞外侧。疾病相关残基R200可能在稳定NTD构象中发挥重要作用。D137-R342对于锚定胞内开口方向,R227-D445锚定胞外开口构象至关重要。该研究对S1P转运的结构和功能研究揭示了Spns2的S1P转运机制,为Spns2抑制剂新化学支架的优化或探索提供了基础。
原文链接:
https://doi.org/10.1038/s41422-023-00908-x
参考文献:
Ren, R., et al., A Glimpse of the Structural Biology of the Metabolism of Sphingosine-1-Phosphate. Contact, 2021. 4.
Wu, X., et al., An LC-MS-based workflow measures the export activity of S1P transporters. Biochemical and Biophysical Research Communications, 2023. 668: p. 118-124.




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台