
治疗诱导肿瘤细胞衰老(Treatment induced senescence, TIS)并结合衰老细胞清除剂(Senolytics)处理是近年来肿瘤治疗的一种新策略。与传统的用药直接杀死肿瘤细胞的方法相比,这种“组合拳”式的策略对某些特定遗传背景的肿瘤细胞更加特异和有效。例如,由于p53突变导致DNA损伤修复缺陷,细胞周期调节因子CDC7特异的抑制剂XL413可以诱导携带p53突变的肿瘤细胞衰老,后者对mTOR抑制剂异常敏感;CDC7抑制剂和mTOR抑制剂联合用药可有效地抑制p53突变的肿瘤进展1。然而,目前关于诱导肿瘤细胞衰老并鉴定新的Senotylic靶点的报道较少。
2024年1月2日,国际知名肿瘤学杂志Nature Cancer发表了题为Blocking methionine catabolism induces senescence and confers vulnerability to GSK3 inhibition in liver cancer的论文,该研究由复旦大学代谢与整合生物学研究院(代谢院)李福明课题组联合复旦大学人类表型组研究院刘苹羽课题组以及美国宾夕法尼亚大学医学院M. Celeste Simon实验室合作完成。研究发现,抑制甲硫氨酸分解代谢可诱导p53突变的肝癌细胞衰老,并鉴定出GSK3作为全新的Senotylic靶点。

甲硫氨酸作为一种必须氨基酸参与蛋白质合成、维持细胞代谢和生长。临床前研究表明,限制饮食中甲硫氨酸水平可延缓衰老、增加结肠癌和肉瘤放化疗效果2,却反而促进肝纤维化和肝肿瘤进展3。本研究中,作者发现剥夺外源甲硫氨酸或者抑制MAT2A介导的甲硫氨酸分解代谢降低细胞内SAM水平,引起全基因组水平低甲基化;后者上调细胞周期抑制因子(如p21和p15等)和促进DNA损伤累积,最终导致细胞衰老。值得注意的是,MAT2A作为一个在促癌基因,在肝肿瘤中高表达且与病人不良预后相关。为了鉴定新的Senolytic靶点,研究者筛选了160个激酶小分子抑制剂,最终发现抑制GSK3特异地导致衰老细胞死亡,却只是部分地抑制正常肿瘤细胞增殖。进一步发现,抑制GSK3部分地通过诱导线粒体依赖的细胞凋亡发挥作用。最后,研究者利用肝癌异源移植瘤模型和高压尾静脉注射MYC过表达转座子质粒和Trp53 CRISPR 敲除质粒构建原发性肝癌基因工程小鼠模型,证实MAT2A抑制剂FIDAS-5和GSK3抑制剂LY2090314联合用药显著抑制了肿瘤进展。
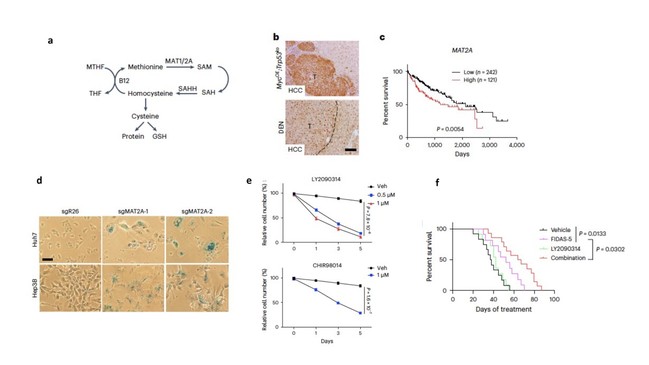
图1 靶向MAT2A介导的甲硫氨酸分解代谢诱导肝癌细胞衰老并对GSK3抑制剂敏感
总之,本研究揭示了甲硫氨酸维持肝癌细胞代谢和增殖的重要功能,建立了抑制MAT2A诱导肿瘤细胞衰老的新策略,并鉴定出GSK3作为新的Senolytic靶点 (图1)。目前,数个公司正在开发新的MAT2A抑制剂,其中AG270已进入到I期临床试验,而GSK3抑制剂已有II期临床试验结果。基于本研究,美国宾夕法尼亚大学医学院和加州大学旧金山分校医学院计划开展基于MAT2A和GSK3抑制剂联合治疗肝癌的I期临床试验。
本研究获得上海市科委“浦江人才”计划资助,得到了代谢院王冠琳课题组提供的生物信息学支持。
原文链接:
https://www.nature.com/articles/s43018-023-00671-3
参考文献:
Wang, C. et al. Inducing and exploiting vulnerabilities for the treatment of liver cancer. Nature 574, 268–272 (2019).
Gao, X. et al. Dietary methionine influences therapy in mouse cancer models and alters human metabolism. Nature 572, 397–401 (2019).
Ma, C. et al. NAFLD causes selective CD4+ T lymphocyte loss and promotes hepatocarcinogenesis. Nature 531, 253–257 (2016).




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台