
溶酶体作为真核细胞中一种高度保守的细胞器,其经典功能是负责降解蛋白质、核酸、多糖等各种生物大分子。而近年来的研究表明,溶酶体同时也是汇聚多种细胞核心信号通路(如mTORC1, AMPK, JAK2-STAT3)的感应中枢,在营养感知、细胞生长、能量代谢、免疫反应和衰老过程中发挥着重要作用[1-3]。为了维持能量稳态和蛋白质质量控制,溶酶体还不断与其他细胞器,例如线粒体、内质网等,进行通信[4]。然而,溶酶体本身是否参与了线粒体应激信号的感应,以及该感应过程如何介导了线粒体与细胞核的交流仍然知之甚少。
线粒体非折叠蛋白反应(UPRmt)是线粒体应激反应(MSR)的一个重要分支,是一种有助于解决由各种线粒体应激所引发的蛋白质毒性的适应性转录应激反应[5]。在哺乳动物细胞中,线粒体应激可以引起综合应激反应(ISR)[6],其核心事件为真核翻译起始因子2α(EIF2α)的磷酸化,该磷酸化可以导致转录因子,包括激活转录因子4(ATF4)的大量翻译,并最终引起UPRmt的激活。然而,由ATF4所主导的转录激活过程同时也被内质网未折叠蛋白反应(UPRer)所共用。因此,细胞如何区分来自线粒体或内质网等不同细胞器的应激信号,以相对应地激活由ATF4共同控制的所谓“综合应激反应”仍然未知。
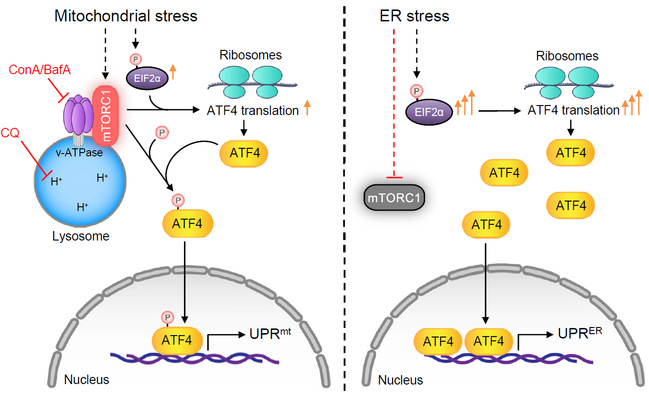
2023年9月7日,复旦大学代谢与整合生物学研究院李阳Terytty课题组与瑞士洛桑联邦理工学院(EPFL)Johan Auwerx课题组合作,在Cell Discovery期刊以Article长文的形式发表了文章Lysosomes mediate the mitochondrial UPR via mTORC1-dependent ATF4 phosphorylation, 报道了溶酶体在调控线粒体应激反应中的重要作用。该工作表明,在线粒体应激下,溶酶体上的v-ATPase/mTORC1复合体可以发生活化,并通过mTOR激酶对转录因子ATF4的直接磷酸化作用引起细胞核内UPRmt的激活。有趣的是,由溶酶体和mTORC1所介导的ATF4磷酸化过程只在线粒体应激的情况下发生,而内质网应激所引起的UPRer的激活则不受此过程的影响。据此,该研究首次揭示了哺乳动物细胞可通过调控ATF4的磷酸化来感知不同细胞器来源的应激信号,从而激活维持对应细胞器稳态的转录应激反应的调控机制。

该研究首先利用了一系列针对位于溶酶体表面负责酸化溶酶体的质子泵v-ATPase的核心亚基的sgRNA和小分子抑制剂(Bafilomycin A1与Concanamycin A),探索了溶酶体酸性环境的改变对细胞响应由多西环素(Doxycycline)、抗霉素A(Antimycin A)和线粒体氧化磷酸化解偶联剂(FCCP)等线粒体刺激所引起的UPRmt转录激活的影响。结果显示,抑制溶酶体酸化后,各类UPRmt基因的激活受到了显著阻滞。而同时,许多经典的响应内质网应激的ATF4-UPRer信号通路的下游基因,在溶酶体酸化被破坏后,其表达水平反而出现了更多的上调。这让研究者们意识到,溶酶体很可能是细胞特异性响应线粒体应激的关键调控节点。进一步的工作表明,溶酶体酸化的抑制可以显著增加转录因子ATF4的蛋白稳定性,从而引起其蛋白表达量升高,并进而导致UPRer信号通路经典下游基因的上调表达。然而,更多的ATF4的蛋白积累,却没有引起UPRmt下游基因的激活,这暗示着ATF4可能存在一个翻译后修饰,该修饰一方面可以响应线粒体应激,另一方面则受到溶酶体活力变化的影响。
通过一系列后续实验,作者最终锁定了位于溶酶体表面的v-ATPase/mTORC1复合物为响应线粒体刺激的关键感应蛋白,感受到线粒体应激信号的mTORC1作为蛋白质激酶复合体可以进一步直接磷酸化转录因子ATF4。通过利用点突变回补实验,研究者们最终揭示了该磷酸化的发生是ATF4结合到UPRmt基因的启动子区域,并引起UPRmt激活的先决条件。另一方面,内质网应激则不改变,甚至是一定程度上抑制了mTORC1对于ATF4的磷酸化作用,而此时,由EIF2α磷酸化的大幅度增强所引起的ATF4的翻译增加,则对UPRer的激活起到了更为主要的作用。
复旦大学代谢与整合生物学研究院李阳Terytty青年研究员、EPFL博士后Qi Wang和Arwen W. Gao为该工作共同第一作者,李阳Terytty与EPFL的Johan Auwerx教授为文章的共同通讯作者。复旦大学代谢与整合生物学研究院为第一完成单位。
值得一提的是,在秀丽隐杆线虫中,溶酶体介导UPRmt激活的作用也依然保守存在,只是在具体分子机制上有一定不同。相关工作于今年1月2日以V-ATPase/TORC1-mediated ATFS-1 translation directs mitochondrial UPR activation in C. elegans为题发表在Journal of Cell Biology杂志[7](该工作同样由李阳Terytty博士等与Johan Auwerx教授合作完成)。
总的来说,这两项分别在哺乳动物细胞和线虫中完成的工作共同揭示了溶酶体在感应线粒体应激信号过程中发挥的重要作用,发现了溶酶体表面的v-ATPase/mTORC1复合体通过直接磷酸化哺乳动物转录因子ATF4或增加线虫中ATFS-1的翻译的方式促进细胞核内UPRmt的转录激活的调控机制。考虑到线粒体应激、溶酶体活力、mTORC1和ATF4信号通路在细胞命运决定、生物体寿命和疾病发生等生物学过程的多维度影响,该发现对于我们理解细胞如何感知各种细胞器应激信号,并准确高效地做出响应,从而维持各细胞器稳态和机体健康将具有积极意义。
原文连接:
https://www.nature.com/articles/s41421-023-00589-1
参考文献:
A. Ballabio, J.S. Bonifacino, Lysosomes as dynamic regulators of cell and organismal homeostasis, Nat Rev Mol Cell Biol 21(2) (2020) 101-118.
C.S. Zhang, B. Jiang, M.Q. Li, M.J. Zhu, Y.Y. Peng, Y.L. Zhang, Y.Q. Wu, T.Y. Li, Y. Liang, Z.L. Lu, G.L. Lian, Q. Liu, H.L. Guo, Z.Y. Yin, Z.Y. Ye, J.H. Han, J.W. Wu, H.Y. Yin, S.Y. Lin, S.C. Lin, The Lysosomal v-ATPase-Ragulator Complex Is a Common Activator for AMPK and mTORC1, Acting as a Switch between Catabolism and Anabolism, Cell metabolism 20(3) (2014) 526-540.
Y. Sun, M. Li, D. Zhao, X. Li, C. Yang, X. Wang, Lysosome activity is modulated by multiple longevity pathways and is important for lifespan extension in C. elegans, Elife 9 (2020).
C.M. Deus, K.F. Yambire, P.J. Oliveira, N. Raimundo, Mitochondria-Lysosome Crosstalk: From Physiology to Neurodegeneration, Trends Mol Med 26(1) (2020) 71-88.
A. Mottis, S. Herzig, J. Auwerx, Mitocellular communication: Shaping health and disease, Science 366(6467) (2019) 827-832.
M. Costa-Mattioli, P. Walter, The integrated stress response: From mechanism to disease, Science 368(6489) (2020).
T.Y. Li, A.W. Gao, X. Li, H. Li, Y.J. Liu, A. Lalou, N. Neelagandan, F. Naef, K. Schoonjans, J. Auwerx, V-ATPase/TORC1-mediated ATFS-1 translation directs mitochondrial UPR activation in C. elegans, J Cell Biol 222(1) (2023).




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台