
近年来,以免疫检查点阻断(ICB)为代表的癌症免疫疗法已经大获成功,并成为未来治疗多种肿瘤的重要基础【1-2】。然而,肿瘤中杀伤性T细胞的系统性缺失以及复杂的肿瘤微环境均会影响免疫治疗效果。因此,在临床上急需开发出能有效促进效应T细胞在肿瘤中浸润的新型抗肿瘤药物。
ADP核糖基化因子1(Arf1)属于Ras小GTPase家族成员,参与调控机体多种重要的生理过程【3-5】。然而,多项研究表明Arf1在许多人类癌症中都高表达,如肝癌、结肠癌、乳腺癌等。因此,Arf1是一个潜在的肿瘤治疗靶点。然而,目前靶向Arf1的抑制剂普遍存在高毒性和特异性差的缺陷,因此,亟需开发出更加安全有效的新型Arf1抑制剂。
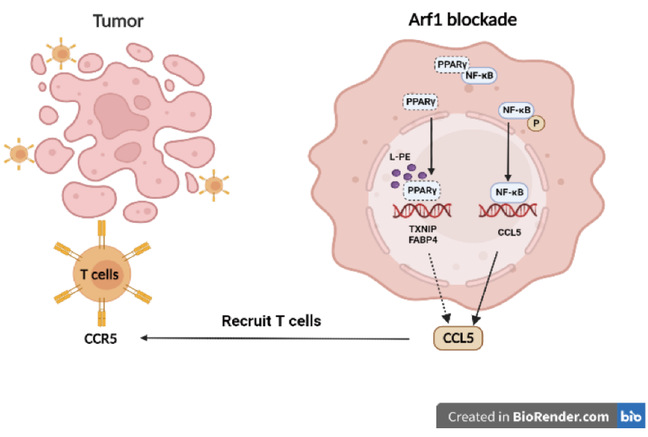
2023年9月6日,复旦大学侯宪玉研究团队在Life Metabolism杂志上发表题为Blockade of Arf1-mediated lipid metabolism in cancers promotes tumor infiltration of cytotoxic T cells via the LPE-PPARγ-NF-κB-CCL5 pathway的研究论文。团队前期研究发现敲除Arf1介导的脂代谢过程能有效杀死肿瘤以及癌症干细胞(CSCs),并激发抗肿瘤免疫反应【6】。本项研究工作则重点解析了阻断Arf1如何通过影响脂代谢从而促进细胞毒性T淋巴细胞在肿瘤内部浸润,进而诱发抗肿瘤免疫应答的作用机制。这将为高表达Arf1的癌症患者提供一个新的治疗选择,并可能辅助现有的免疫疗法改善患者临床治疗效果。

首先,团队前期研发出的2种新型Arf1抑制剂都能显著增加肿瘤内T细胞的浸润程度,组织RNA测序发现趋化因子与T细胞具有强关联性。通过检测多种趋化因子的表达水平以及肿瘤-免疫细胞共培养系统,研究小组发现抑制Arf1主要通过上调CCL5进而影响T细胞的迁移。另外,体内实验也表明CCL5对于Arf1缺失所介导T细胞浸润和抗肿瘤免疫应答至关重要。
接下来为了探究抑制Arf1如何干预CCL5转录的调控机制,团队对 TCGA 数据库中肝癌患者的 RNA 序列数据进行了相关性分析,发现与正常组织相比,过氧化物酶体增殖激活受体γ(PPARγ)信号通路在肿瘤组织中激活程度较低,说明激活PPARγ可能有助于抑制肿瘤生长。团队发现,抑制Arf1能激活PPARγ信号通路,上调其下游基因(CIDEC、FABP4、NR1D1和TXNIP等)的表达水平,说明PPARγ被有效激活。PPARγ 是一种转录调节因子【7-9】,可被不饱和脂肪酸活化。通过脂质组学分析,研究者发现,阻断Arf1上调了多种不饱和脂肪酸(SUFA)和磷脂酰乙醇胺(PE 18:1)的水平,其中溶血磷脂酰乙醇胺 (LPE)增加最为明显。进一步实验结果显示LPE确实上调了PPARγ信号通路中下游基因的表达水平,说明抑制Arf1可能通过不饱和脂肪酸LPE影响PPARγ的激活。
有研究发现核因子kappa B(NF-κB)是CCL5的主要转录因子【10】。研究团队于是进一步分析了 NF-κB是否参与CCL5 的转录调控。首先他们通过western blot和免疫组化(IHC)发现抑制Arf1会增加磷酸化p65的表达水平,并且ChIP-qPCR揭示NF-κB蛋白与CCL5启动子区域的结合能力也显著增强。而一旦阻断NF-κB(JSH23),Arf1抑制剂通过趋化因子CCL5介导的抗肿瘤免疫效应则被明显抑制,说明抑制Arf1可能通过NF-κB-CCL5轴招募T细胞进而发挥抗肿瘤作用。
那么由不跑和脂肪酸LPE激活的PPARγ和NF-κB之间存在何种关联呢?通过免疫共沉淀(Co-IP)实验,研究小组发现LPE能削弱PPARγ和NF-κB的直接结合,而且阻断Arf1结果亦是如此,说明Arf1能够干预两者的相互作用。为了进一步探究PPARγ-NF-κB 是否会对CCL5 转录调控造成影响,研究团队通过凝胶迁移实验(EMSA)观察到迁移条带仅出现在CCL5探针和P65蛋白共孵育的泳道中。而当CCL5 探针与PPARγ 蛋白和 P65 蛋白一起孵育时,则没有检测到迁移的条带,表明 PPARγ 蛋白和 CCL5 探针可能竞争结合P65 蛋白,充分证明了PPARγ-NF-κB-CCL5之间的作用关系。
综上所述,阻断 Arf1 会诱导产生不饱和脂肪酸(LPE),这种脂肪酸能结合 PPARγ 并将其从胞质PPARγ-NF-κB复合体中“夺取”出来。被“释放”的NF-κB发生磷酸化并转运到细胞核中,从而调节趋化因子 CCL5 的转录。CCL5 与细胞毒性T细胞表面的CCR5受体结合进而招募其浸润到肿瘤中去,最终消退肿瘤(图1)。因此,通过阻断Arf1调控LPE-PPARγ-NF-κB-CCL5轴能有效促进杀伤性T 细胞迁移至肿瘤内部从而发挥抗肿瘤作用,这可能为肿瘤免疫疗法提供一种新策略。
复旦大学生命科学学院2019级博士研究生王娜和2021级硕士研究生姚天歌为本文的共同第一作者。复旦大学侯宪玉教授和青年副研究员王月桐为本文的共同通讯作者。团队研发的新型Arf1抑制剂目前已申报了PCT国际专利。
原文链接:
https://doi.org/10.1093/lifemeta/load036
参考文献:
M. Reck et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med 2016; 375:1823-1833.
J. D. Wolchok et al. Nivolumab plus ipilimumab in advanced melanoma. N Engl J Med 2013; 369:122-133.
B. Kaczmarek, J. M. Verbavatz, C. L. Jackson. GBF1 and Arf1 function in vesicular trafficking, lipid homoeostasis and organelle dynamics. Biol Cell 2017; 109:391-399.
J. G. Donaldson, C. L. Jackson. ARF family G proteins and their regulators: roles in membrane transport, development and disease. Nat Rev Mol Cell Biol 2011; 12:362-375.
C. D'Souza-Schorey, P. Chavrier. ARF proteins: roles in membrane traffic and beyond. Nat Rev Mol Cell Biol 2006; 7:347-358.
G. Wang et al. Arf1-mediated lipid metabolism sustains cancer cells and its ablation induces anti-tumor immune responses in mice. Nat Commun 2020; 11:220.
F. A. Monsalve, R. D. Pyarasani, F. Delgado-Lopez, R. Moore-Carrasco. Peroxisome proliferator-activated receptor targets for the treatment of metabolic diseases. Mediators Inflamm 2013; 2013:549627.
Grygiel-Górniak B. Peroxisome proliferator-activated receptors and their ligands: nutritional and clinical implications--a review. Nutr J 2014; 13:17.
A. Christofides, E. Konstantinidou, C. Jani, V. A. Boussiotis. The role of peroxisome proliferator-activated receptors (PPAR) in immune responses. Metabolism 2021; 114:154338.
C. Werts et al. Nod1 and Nod2 induce CCL5/RANTES through the NF-kappaB pathway. Eur J Immunol 2007; 37:2499-2508.




 复旦大学网上办事服务大厅
复旦大学网上办事服务大厅 复旦大学实验室安全教育与管理平台
复旦大学实验室安全教育与管理平台